来源:好本子
2024 年 4 月发表在 Advanced Science 杂志上的这篇研究论文,探讨炎症性成纤维细胞样滑膜细胞(FLSs)衍生的外泌体如何通过增强巨噬细胞的糖酵解作用来加剧骨关节炎(OA)的病理进程。通过结合代谢组学和 RNA 测序分析,论文全面地描绘了外泌体对巨噬细胞代谢和基因表达的影响,为深入理解其在 OA 中的作用机制提供了多维度的数据。此外,论文不仅在体外细胞模型中验证了外泌体的作用,还通过在小鼠 OA 模型中的体内实验进一步证实了其对疾病进展的影响,增强了研究结论的可靠性。
 图源:Advanced Science
图源:Advanced Science研究背景
骨关节炎(OA)一种常见的关节疾病,是一种影响关节囊内外多个解剖结构的全身性疾病,目前,OA 的治疗主要集中在使用局部或口服非甾体抗炎药来缓解疼痛,而对于晚期 OA 患者,需要不可避免地使用到关节置换手术。成纤维细胞样滑膜细胞(FLSs)是健康和 OA 滑膜中最丰富的细胞类型,此外巨噬细胞也在 OA 中起着关键作用,该研究旨在研究 FLSs 衍生的外泌体及其在 OA 发展中的作用以及这些外泌体如何影响巨噬细胞的极化和功能,从而为 OA 治疗提供新的视角和潜在靶点。
研究思路
研究团队分析了来自 OA 患者和对照组的滑膜组织样本,观察到 OA 患者 FLSs 中外泌体分泌的增加,以及与炎症相关的生物标志物的变化。接下来,研究团队使用体外细胞培养模型,模拟 OA 中的炎症环境,分离外泌体并通过纳米粒子追踪分析(NTA)、透射电子显微镜(TEM)和西方印迹法(WB)等技术对它们进行表征,随后利用 Seahorse 生物能量分析仪评估巨噬细胞代谢并通过 RNA 测序(RNA-seq)、定量实时聚合酶链反应(qRT-PCR)和 WB 等技术,分析外泌体刺激的巨噬细胞中基因和蛋白表达的变化。最后进行体内模型验证以及药物干预实验阐明外泌体在 OA 中的作用机制,并探索新的治疗策略。
研究结果
1. 外泌体分泌在 OA 滑膜和炎性 FLS 中升高对比来自 OA 患者和对照组的滑膜组织样本的 HE 染色图像,研究团队发现 OA 滑膜中存在大量细胞浸润。为了研究滑膜外泌体在 OA 中的作用,研究团队分析了外泌体生物发生的关键调节因子 RAB 27 A 的表达,发现 OA 滑膜中 RAB27A 表达上调,提示外泌体分泌在 OA 中增加。此外,研究团队使用体外细胞培养模型,模拟 OA 中的炎症环境,刺激 FLSs 并观察外泌体的分泌情况,纳米颗粒示踪分析显示体外炎症刺激下,FLS 外泌体分泌也增加。
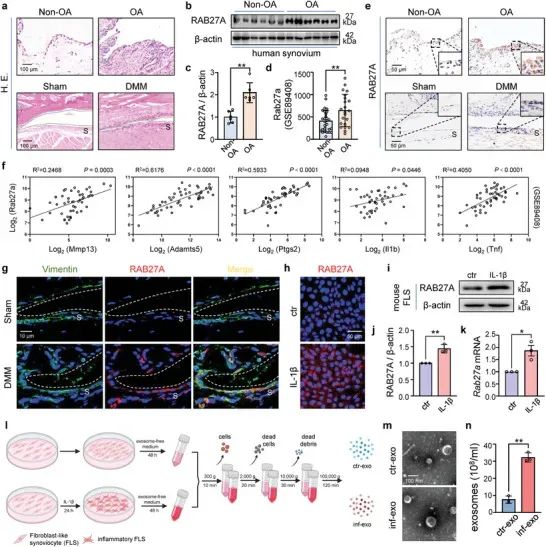 图 1:外泌体分泌在 OA 滑膜和炎性 FLS 中升高
图 1:外泌体分泌在 OA 滑膜和炎性 FLS 中升高2. 炎症性 FLS 源性外泌体在 M1 极化中的病理作用基因本体富集分析显示 iNOS 阳性细胞(M1 样巨噬细胞的标志物)和 NLRP 3 阳性细胞(炎性小体活化的标志物)显著增加。鉴于滑膜内 FLS 和巨噬细胞之间空间接近,研究团队假设来源于炎性 FLS 的外泌体破坏巨噬细胞极化。通过体外共培养系统和直接刺激,研究显示外泌体增加了 M1 型巨噬细胞标记物的表达。关节内注射等体积的非 OA FLS 衍生的外泌体、IL-1β 刺激的 OA FLS(inf-exo)的外泌体或生理盐水后,inf-exo 注射导致滑膜增生和细胞浸润显著增加。总的来说,以上研究结果说明来源于炎性 FLS 的外泌体可以在体外和体内诱导 M1 样巨噬细胞极化。
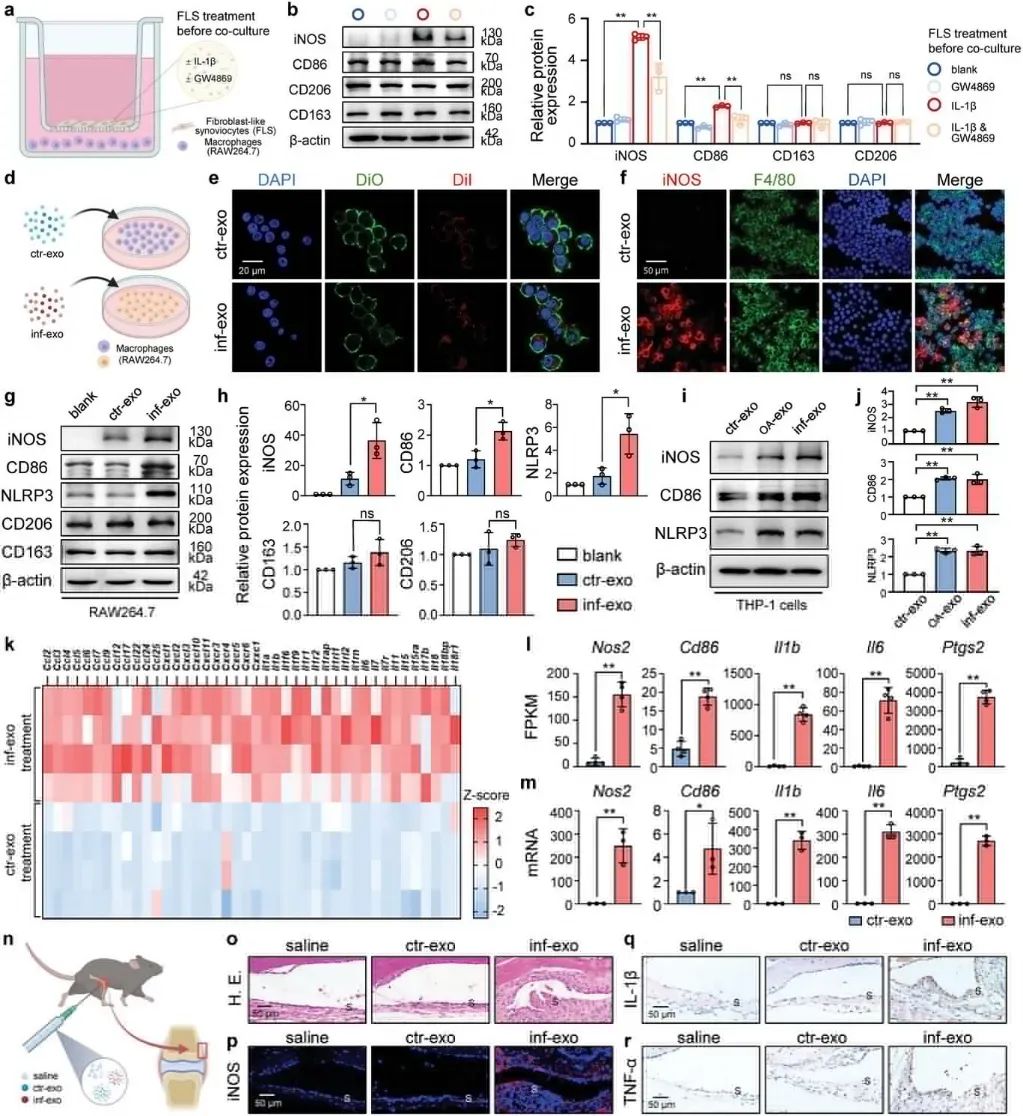 图 2:炎症性 FLS 源性外泌体在 M1 极化中的病理作用
图 2:炎症性 FLS 源性外泌体在 M1 极化中的病理作用3. inf-exo 预处理的巨噬细胞诱导共培养软骨细胞 OA 样表型软骨变性是 OA 的主要病理表现,其特征是过度活化的分解代谢和细胞凋亡。考虑到巨噬细胞在 OA 中的病理作用,研究团队假设用 inf-exo 引发的巨噬细胞可能会破坏共培养软骨细胞的行为,共培养后进行实验发现 inf-exo 预处理的巨噬细胞在共培养条件下对软骨细胞产生了负面影响,包括蛋白多糖含量降低、合成代谢标志物减少、细胞活力降低、细胞凋亡增加以及软骨细胞的代谢状态改变。综上所述,这些发现表明,用 inf-exo 引发的巨噬细胞可以在共培养的软骨细胞中诱导 OA 样表型。
 图 3:inf-exo 预处理的巨噬细胞诱导共培养软骨细胞 OA 样表型
图 3:inf-exo 预处理的巨噬细胞诱导共培养软骨细胞 OA 样表型4. 关节腔内注射 inf-exo 促进小鼠实验性骨关节炎的形成随后,研究团队在小鼠模型中进行关节腔内注射 inf-exo, 发现来源于炎性 FLS 的外泌体在体内也能加剧 OA 的进展,表现为更严重的软骨退化和滑膜炎症的加剧。
 图 4:inf-exo 预处理的巨噬细胞诱导共培养软骨细胞 OA 样表型
图 4:inf-exo 预处理的巨噬细胞诱导共培养软骨细胞 OA 样表型5. inf-exo 触发的糖酵解激活促进巨噬细胞炎症在外泌体刺激巨噬细胞 48 小时后,研究团队观察到细胞培养上清液颜色的显著变化,表明外泌体刺激导致上清液 pH 水平的变化,进一步研究发现糖酵解活化关键的酶 GLUT1、HK2、PKM2 和 LDHA 表达水平增加,进一步采用 Seahorse 测定来研究细胞糖酵解的状态,观察到用 inf-exo 处理的巨噬细胞中显著更高的糖酵解速率和增强的糖酵解能力,靶向代谢组学分析也表明糖酵解在 inf-exo 刺激的巨噬细胞中被激活。使用 2-DG 破坏巨噬细胞糖酵解后可以减轻 M1 型极化和炎症激活。这些发现表明糖酵解可能是 M1 样极化和炎症基因表达的潜在机制。
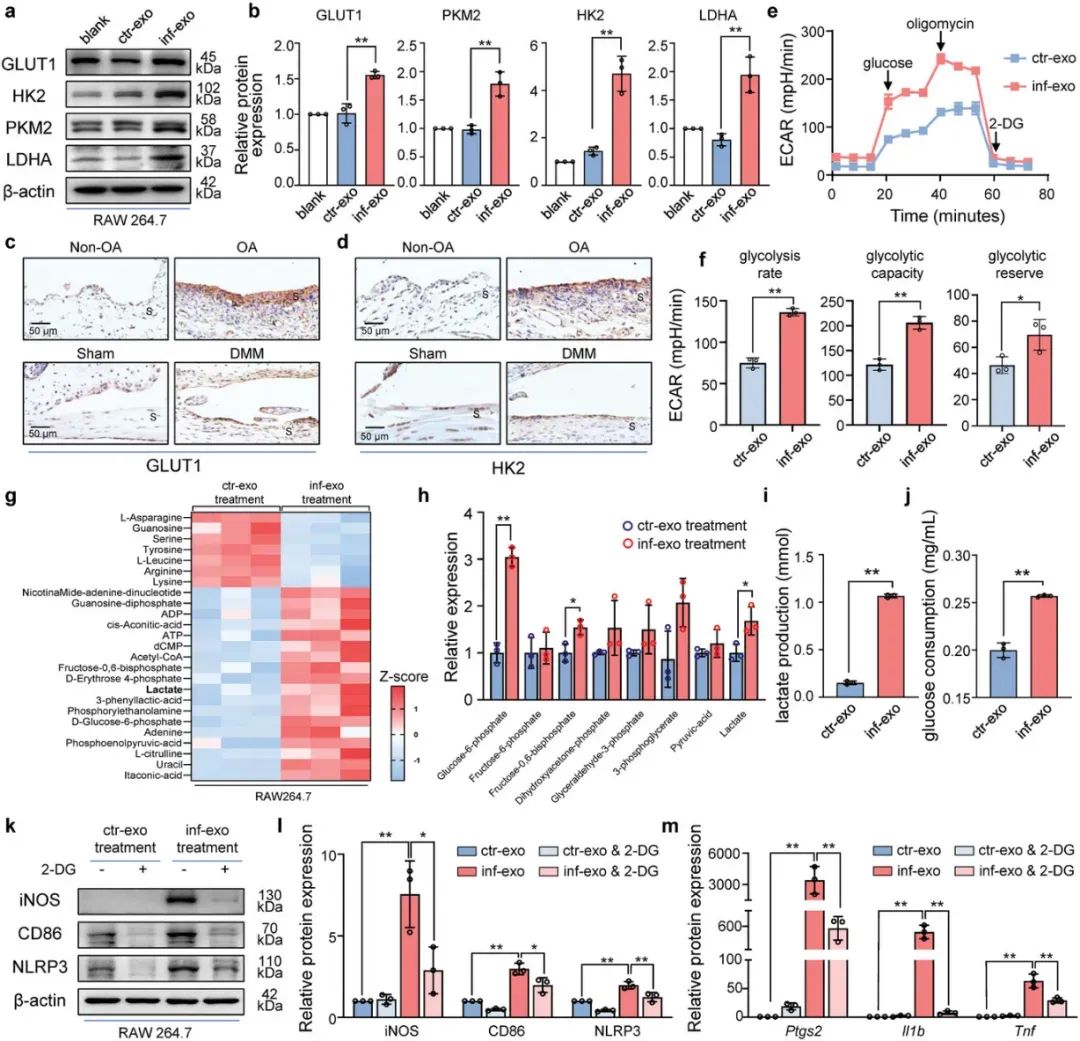 图 5:inf-exo 触发的糖酵解激活促进巨噬细胞炎症
图 5:inf-exo 触发的糖酵解激活促进巨噬细胞炎症6. HIF1A 是 inf-exo 触发的糖酵解激活和极化的关键转录因子inf-exo 刺激的巨噬细胞中四种糖酵解基因(Slc 2a 1、Hk 2、Pkm 和 Ldha)显著增加。通过 ChIP 分析筛选了上述四种糖酵解基因的上游转录因子,此外,基于 ChEA 3 数据库的预测,HIF 1A 被鉴定为排名第一的转录因子。CHIP 实验证明 inf-exo 刺激的巨噬细胞在启动子区中显示出积聚 HIF 1A 的显著增加。然后,研究团队在体内和体外研究了 OA 下 HIF 1A 的表达发现 OA 患者的滑膜中 HIF 1A 表达上调。PX-478 抑制 HIF 1A 后,inf-exo 诱导的 M1 样极化和糖酵解酶的上调作用被减弱。总的来说,研究显示 HIF1A 在调控糖酵解基因表达中发挥重要作用。
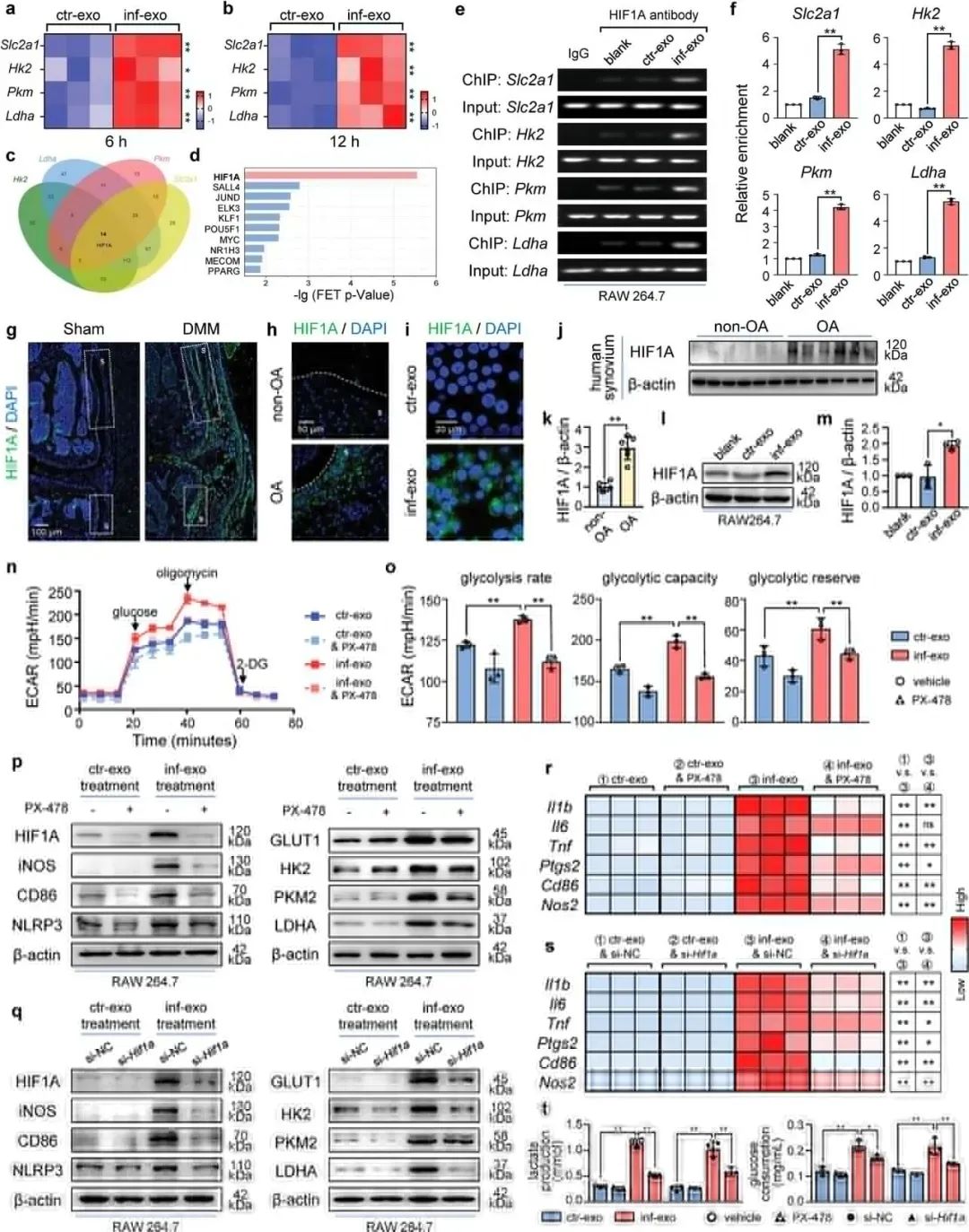 图 6:HIF1A 是 inf-exo 触发的糖酵解激活和极化的关键转录因子
图 6:HIF1A 是 inf-exo 触发的糖酵解激活和极化的关键转录因子7. HIF1A 药理学抑制减轻 inf-exo 触发的巨噬细胞病理作用为了研究 HIF 1A 在 inf-exo 触发的巨噬细胞功能障碍中的作用,研究团队在 inf-exo 刺激之前以及与软骨细胞共培养之前,使用 PX-478 抑制巨噬细胞中的 HIF 1A 表达和活性,研究显示使用 HIF1A 抑制剂 PX-478 后,巨噬细胞对软骨细胞的促分解作用显著减弱,细胞增殖标记物和抗凋亡蛋白表达恢复,巨噬细胞对软骨细胞的负面影响减少,此外,小鼠 OA 模型中注射 PX-478 可通过抑制滑膜 HIF 1A 来减弱实验性 OA 的发展。
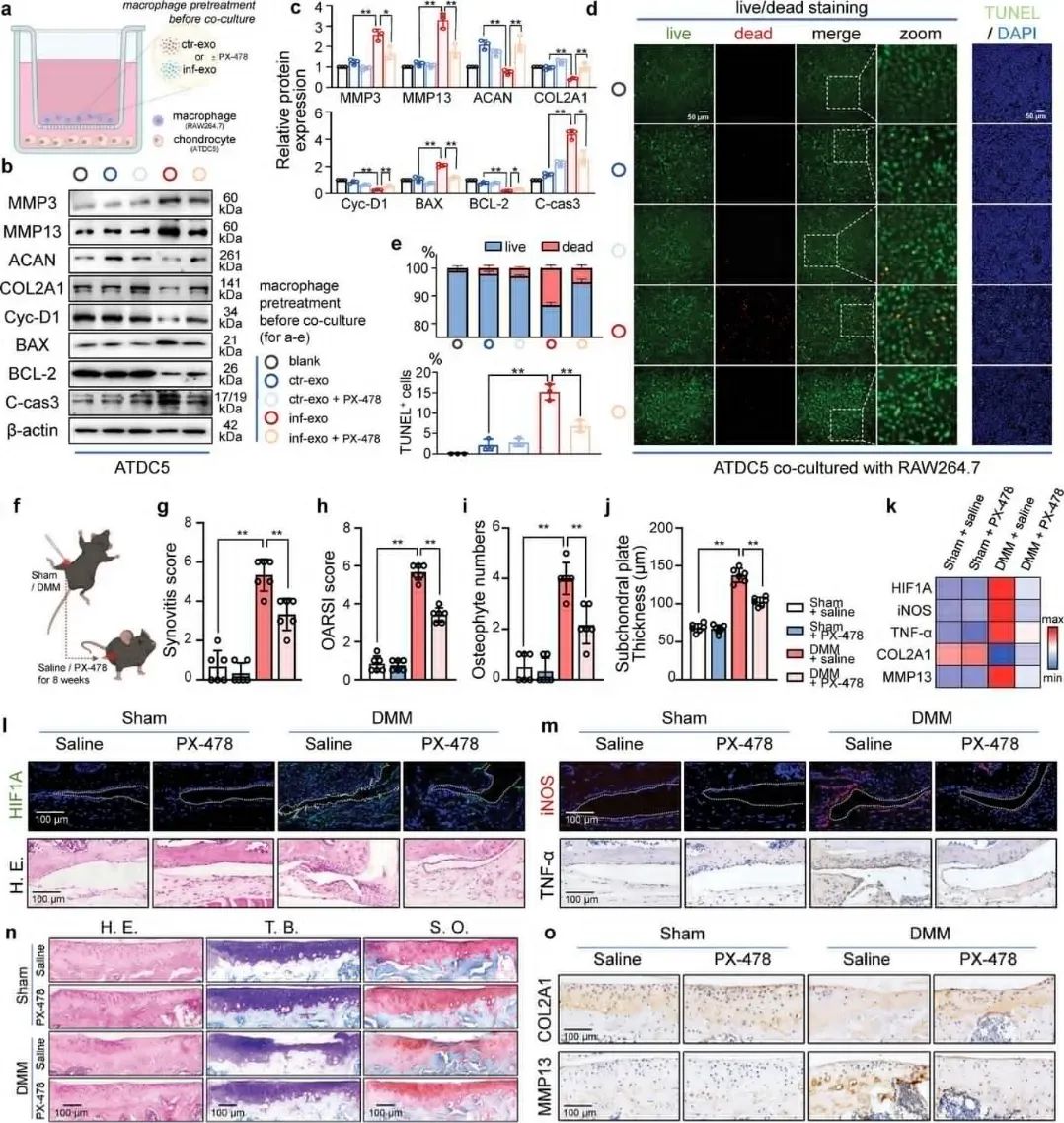 图 7:HIF1A 药理学抑制减轻 inf-exo 触发的巨噬细胞病理作用
图 7:HIF1A 药理学抑制减轻 inf-exo 触发的巨噬细胞病理作用文章小结
总的来说,该论文研究了炎症性成纤维细胞样滑膜细胞(FLSs)衍生的外泌体在骨关节炎(OA)中的作用。研究发现,这些外泌体在 OA 中分泌增加,并通过增强巨噬细胞的糖酵解和 M1 型极化来加剧炎症反应,从而促进 OA 的进展。HIF1A 作为关键的转录因子,调控了这一过程中糖酵解基因的表达。研究还发现,通过药理学手段抑制 HIF1A 能够减轻 OA 的病理变化,显示出作为潜在治疗策略的前景。这些发现为理解 OA 的发病机制提供了新的见解,并可能指导未来的治疗干预。
本文及图片来源于好本子,作者转载