来源:丁香学术
原核生物的 CRISPR-Cas(成簇的规律间隔短回文重复)系统可对入侵的病毒和遗传因子产生适应性免疫。根据 Cas 效应蛋白的组织结构,CRISPR-Cas 系统可分为两大类。第 1 类系统(I、III 和 IV 型)使用多亚基效应器复合体来锁定入侵核酸进行清除,而第 2 类系统(II、V 和 VI 型)则依赖于单一蛋白效应器。新发现的 VII 型 CRISPR-Cas 系统由 III 型 CRISPR-Cas 系统演化而来,与 III 型系统中具有催化活性的 Cas7 不同,VII 型系统中 Cas7 的核酸酶位点是自然失活的,取而代之的是另一种核酸酶效应器 Cas14 来切割靶 RNA,然而其作用机制仍不明确。
2024 年 8 月 14 日,天津医科大学基础医学院生化系、天津市免疫学研究所张恒团队联合中国科学院武汉病毒所邓增钦团队,在 Nature 发表研究。探究了 VII 型 CRISPR-Cas 级联复合体的冷冻电镜结构,发现 Cas14 在溶液中是一个四聚体蛋白,以靶 RNA 依赖的方式被招募到 Cas5-Cas7 复合体中。Cas14 的 N-端催化结构域结合一段底物 RNA 进行切割,而 C-端结构域负责将 Cas14 拴系到 Cas5-Cas7 复合体上。靶 RNA 的切割会因 5′ 末端的互补前缀序列而改变,但 3′ 末端的互补前缀序列不会。研究阐明了Ⅶ型 CRISPR-Cas 系统复合体组装和底物切割的关键分子细节,有助于Ⅶ型 CRISPR-Cas 系统的生物技术工程化应用。

图 1 相关研究(图源:Nature)
1. VII 型 CRISPR-Cas 系统的功能检验
Cas14 的核糖核酸酶活性:新发现的 VII 型 CRISPR-Cas 系统利用 Cas5 和 Cas7 蛋白形成的 CRISPR RNA 引导核糖核蛋白复合体来靶向 RNA,由专用 Cas14 核酸酶执行 RNA 的切割。
Cas14 含有一个 N 端推定催化结构域,该结构域与金属-β-内酰胺酶(MβL)超家族的 β-CASP 核酸酶同源。MβL 和 β-CASP 亚域形成催化槽,可容纳目标 RNA 进行锌依赖性切割。在最初的内切酶切割之后,5′-3′ 外切核酸酶的活性会被激发。
双重核酸酶活性使用同一组活性位点残基。在野生型(WT)Cas14 存在下,靶 RNA 可被切割,而当 Cas14 活性位点中的锌配位残基(D66A/H67A)发生突变时,切割效应就会被消除,这表明锌依赖性催化模式是保守的。因此,Cas14 在结构域组成和底物切割方面不同于其他 CRISPR-Cas 系统的核酸酶效应器,这表明 VII 型系统使用一种新的作用机制。
为了研究 Cas14 在 VII 型 CRISPR-Cas 候选系统底物结合和切割中的作用,作者进行了电泳迁移试验和体外靶标切割试验。由 Cas5-Cas7 复合体和 crRNA 组成的核糖核蛋白复合体(RNP)能与 RNA 和单链(ss)DNA 结合。Cas14 对目标 RNA 或 ssDNA 与 RNP 复合体的结合没有影响。无论是 RNP 复合体还是 Cas14 本身,都没有表现出针对靶 RNA 的核酸酶活性。然而,当 RNP 复合体与 Cas14 蛋白混合时,靶 RNA 可以被有效地切割。Cas14 潜在活性位点残基的丙氨酸取代消除了核酸酶活性。这表明,Cas14 的核糖核酸酶活性依赖于 Cas5-Cas7 复合体。
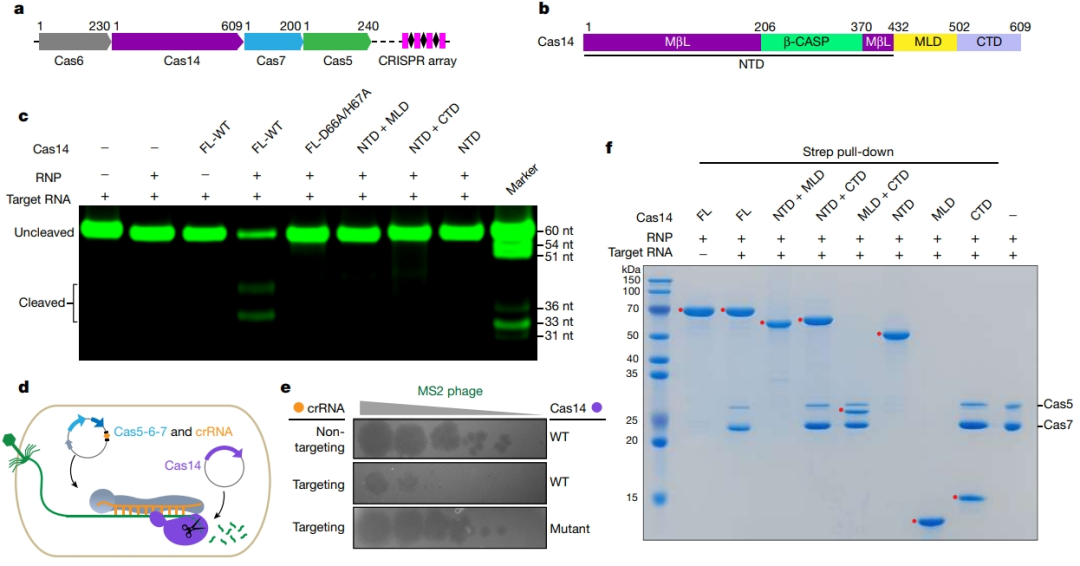
图 2 VII CRISPR–Cas 功能检验 (图源:[1])
靶向 crRNA 能强烈抑制噬菌体斑块的形成。相比之下,MS2 噬菌体能够感染携带非靶向 crRNA 或非活性 Cas14 的细胞。作者还进行了转录抑制实验,其中靶向单体红色荧光蛋白转录本的 crRNA 相对于非靶向 crRNA 和非活性 Cas14 的荧光显著降低。同样,靶向卡那霉素抗性基因(KanR)的 crRNA 增加了卡那霉素的敏感性。只有在靶 RNA 存在下,Cas14 蛋白才能与 Cas5-Cas7 复合体发生了强相互作用,表明存在依赖于靶 RNA 的相互作用机制。
研究思路 1:作者首先研究了 VII 型 CRISPR-Cas 系统的生物化学特征,通过同源性检验确定了 VII 型 CRISPR-Cas 候选系统具有靶向 RNA 的核酸酶 Cas14 蛋白。为检验核酸酶活性,进行了电泳迁移试验和体外靶标切割试验。对 Cas14 蛋白关键残基的作用进行了突变检验。
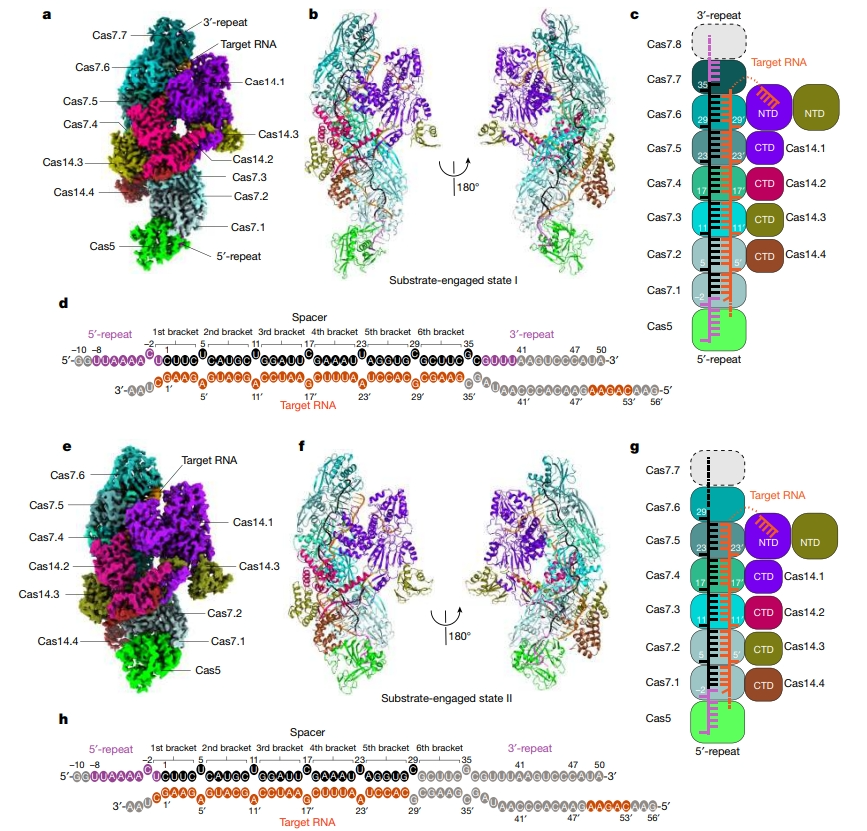
图 3 整体结构研究(图源:[1])
2. VII 型系统复合体的结构
VII 型系统的整体结构:构建了 Cas5-Cas7-crRNA-CTR-Cas14 二元复合体,测定了分辨率为 2.8-2.9 Å 的冷冻电镜结构。Cas5 和 Cas7 蛋白组装成拉长的丝状结构。有四个 Cas14 分子被招募到 Cas5-Cas7 复合体中。Cas5 与 crRNA 的 5′ 端结合,与 Cas7 以头对尾的方式堆叠在一起。每个 5 个核苷酸被 Cas7 相邻的两个拇指部分括起来,称为 5 核苷酸-括弧序列。Cas14 可分为三个部分:N 端催化结构域(NTD)、中间连接域(MLD)和 C 端域(CTD)。截断 NTD 或 MLD 都能保持与 Cas5-Cas7 复合体的结合。因此,CTD 是形成 Cas5-Cas7-Cas14 复合体的主要原因。Cas14 的所有结构域对于靶 RNA 的降解都至关重要。
Cas14 的切割机制是怎样的? Cas14 在溶液中为四聚体,NTD 由一个 MβL 亚域和一个 β-CASP 亚域组成。MβL 亚域采用典型的四层 αββα 折叠,而 β-CASP 亚域则拥有一个五链平行的 β-片层,两侧有六个 α-螺旋。Cas14.1/3 的两个 NTD 部分通过 MβL 亚域连接成一个对称的尾对尾二聚体。MLD 区域介导 Cas14 的四聚体化。当 NTD 二聚化界面或 MLD 四聚化界面的残基发生突变时,寡聚化状态和靶标切割均发生改变。
CTD 与结合靶 RNA 的 Cas5-Cas7 复合体接触较多,从 Cas7 指状部分突出的一个精氨酸残基(Arg77)插入了 CTD α16-α17 环裂隙中。α16-α17 环也通过极性相互作用与目标 RNA 的糖磷酸骨架紧密结合。靶 RNA 与 Cas14 之间广泛的相互作用解释了靶 RNA 依赖性结合模式。当与 Cas7 或靶 RNA 相互作用的残基发生突变时,靶 RNA 的切割会大打折扣。
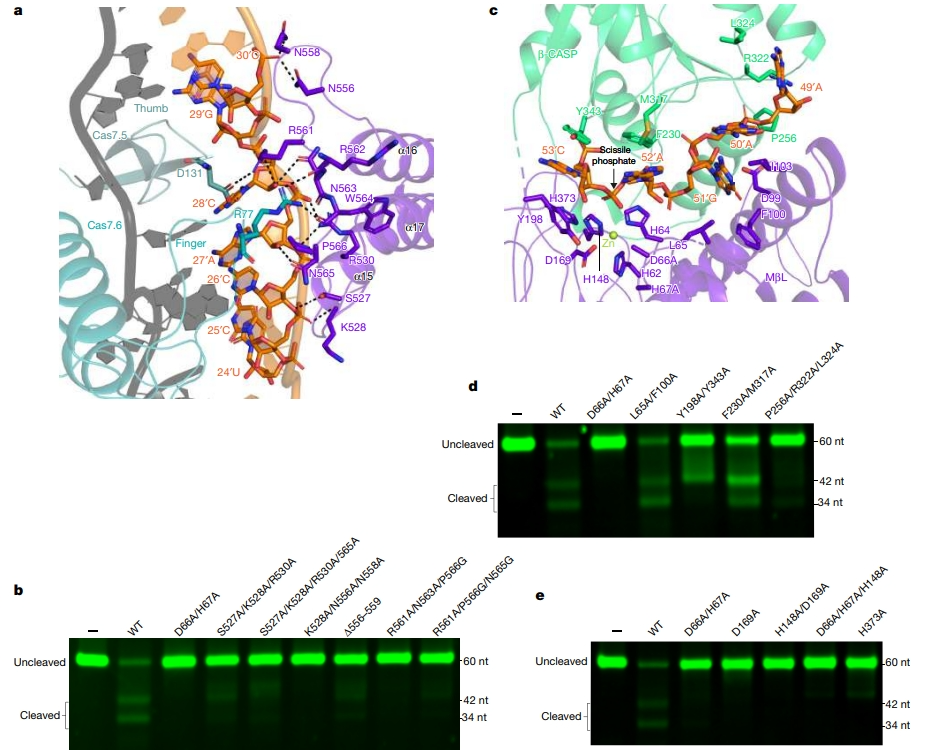
图 4 Cas14 的招募与切割(图源:[1])
进一步构建了在 Cas14.1 亚基的 MβL 和 β-CASP 亚域之间插入潜在催化口袋的五个核苷酸 49′A-53′C。β-CASP 通过 Pro256、Arg322 和 Leu324 对 49′A 进行配位。50′A 和 51′G 主要由 MβL 亚域识别。Ile103 不仅与 50′A 形成碱基堆叠,而且还与 Leu65 和 Phe100 形成疏水袋,以容纳 51′G。52′A 的碱基被 β-CASP 的 Phe230 和 Met317 定向,而 52′A 的鞘状磷酸基则与锌离子键合。53′C 嘌呤碱基被来自 MβL 和 β-CASP 亚域的两个芳香族残基夹在中间。五个组氨酸残基和两个天冬氨酸残基配位一对锌离子。这些组氨酸和天冬氨酸残基的丙氨酸取代会终止靶 RNA 的切割。Cas14 按顺序切割底物,在 52′A 附近的磷酸二酯键处进行第一次切割,括弧-靶 RNA 双链的数量决定了 Cas14 的结合和切割模式。
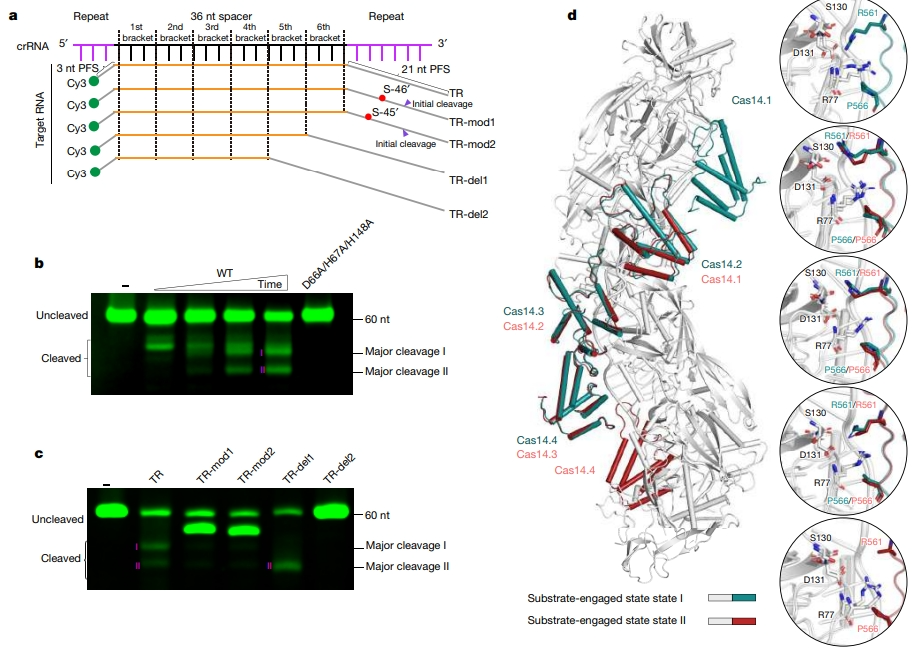
图 5 Cas14 介导的切割中间态(图源:[1])
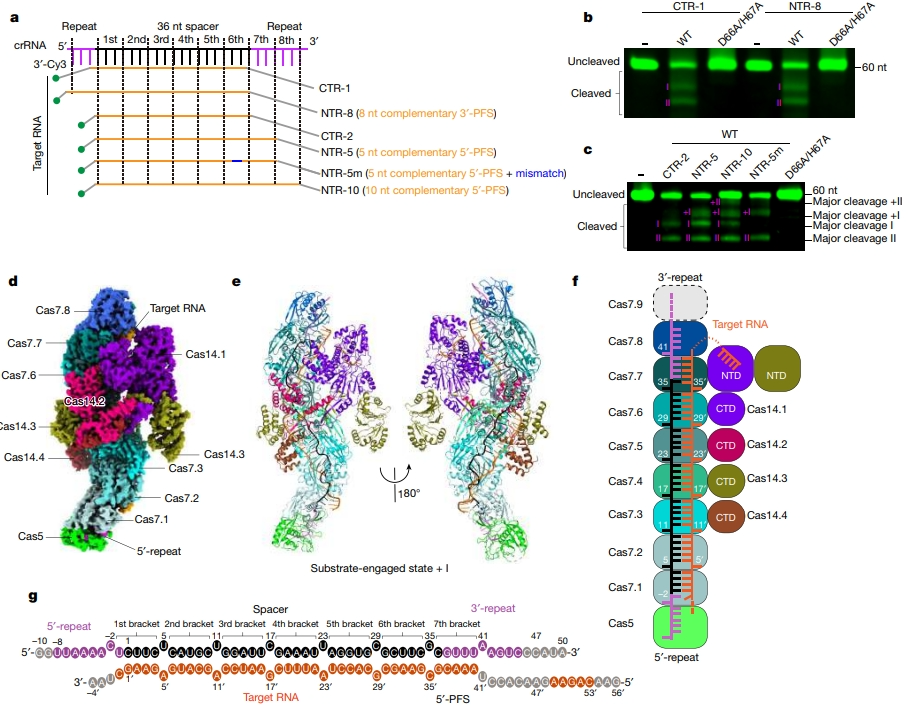
图 6 Cas14 切割机制(图源:[1])
研究思路 2:为进一步揭示 VII 型 CRISPR-Cas 系统分子细节,研究者报告了不同功能状态下与 Cas14 结合的级联复合体的冷冻电镜结构。通过同源物结构比对识别关键残基,通过突变实验验证残基的作用。通过生化切割实验研究捕获的功能构象,揭示出 Cas14 与 Cas5-Cas7 复合体上的不同位点结合执行切割。
总之,研究揭示了 VII 型 CRISPR-Cas 系统的分子细节,为进一步研究 VII 型 CRISPR-Cas 系统的机理提供了框架,这将促进该系统在应用领域的发展以及其在基因编辑中的应用提供了重要理论基础!与 VI 型 CRISPR-Cas13 系统不同,III 型和 VII 型系统均不发生附带切割,是精确操作 RNA 的理想工具。VII 型候选系统比 III 型系统更紧凑,可通过腺病毒等单一载体中传递。
据悉,天津医科大学张恒教授和武汉病毒所邓增钦研究员为论文的共同通讯作者。天津医科大学基础医学院杨洁博士、研究生李徐梓超、何秋秋、王枭燊、王童谣和武汉病毒所研究生唐晶晶为该论文共同第一作者。另外,天津医科大学基础医学朱宪彝班20级本科生张淑琴和刘志坤作为研究团队的重要成员,负责实验设计和结果分析,为研究的顺利进行做出了突出贡献。
通讯作者:(上下滑动查阅)
张恒博士,天津医科大学基础医学院教授博导。2020 年 9 月加入天津医科大学建立结构生物化学实验室。课题组主要运用生物化学、结构生物学、微生物学和生物信息学等方法,研究微生物-宿主互作的分子机制,并开发基因编辑和检测工具。
邓增钦, 中科院武汉病毒研究所研究员,学科组长。中国农业大学, 生物化学与分子生物学, 博士,华盛顿大学博士后,研究方向为结构病毒学。
参考资料:
Yang J et al. Structural basis for the activity of the type VII CRISPR-Cas system. Nature. 2024 Aug.
我们长期为科研用户提供前沿资讯、实验方法、选品推荐等服务,并且组建了 70 多个不同领域的专业交流群,覆盖神经科学、肿瘤免疫、基因编辑、外泌体、类器官等领域,定期分享实验干货、文献解读等活动。如需进群,可以先加实验菌企微哦~
 图片来源:图虫创意如需代发文章宣传、新闻稿、招聘等;或有生物学相关专业背景,有意愿应聘兼职作者的老师,请后台回复【学术】添加小编
图片来源:图虫创意如需代发文章宣传、新闻稿、招聘等;或有生物学相关专业背景,有意愿应聘兼职作者的老师,请后台回复【学术】添加小编转载须知【原创文章】丁香学术原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为丁香学术所拥有。丁香学术保留所有法定权利,违者必究。