来源:丁香学术
有研究表明,脑缺血可动员促炎性单核细胞,并加速其进入外周循环的动脉斑块。虽然已有研究报道上述现象,但脑缺血发生后内皮细胞的特异性改变如何以及其对动脉粥样硬化进展的潜在影响知之甚少。作为动脉粥样硬化的驱动因素,内皮细胞(Endothelial cells, EC)可调控动脉粥样硬化形成的部位特异性,并表达粘附分子以指引髓系细胞进入病变部位。然而,脑缺血发生后内皮特异性改变的动力学尚不清楚,而这对于了解 EC 是否可能对动脉粥样硬化进展产生长期影响至关重要。此外,脑缺血发生后驱动内皮细胞特异性改变的特定信号也是未知的。
2024 年 7 月 29 日,天津医科大学总医院刘强教授、天津医科大学(基础医学院)艾玎教授和周洁教授合作在免疫学顶刊 Immunity 发表研究论文「Brain ischemia causes systemic Notch1 activity in endothelial cells to drive atherosclerosis」(图 1)。在这项研究中,他们使用脑卒中患者队列、单细胞测序、双光子成像和流式细胞术,发现脑缺血可诱导外周血管内皮细胞 Notch1 信号的持续激活,而外周循环内 Notch1 配体的持续增加则可导致衰老的促炎内皮细胞生成,其可驱动脑缺血后动脉粥样硬化的进展,增加脑卒中复发风险。而这一过程可以通过阻断抗体进行靶向治疗。

图 1 相关研究(图源:[1])
1. 脑缺血导致外周内皮细胞持续活化和衰老
首先,研究人员通过分析既往的汇总数据,发现大动脉粥样硬化、心源性栓塞和小血管闭塞导致的脑缺血事件的复发率分别为 9.7%、7.8% 和 4.5%,并且脑缺血发病后 3 个月内的复发和死亡主要由大动脉粥样硬化与心源性栓塞或小血管闭塞引起,这表明有效减少与大动脉粥样硬化相关的早期复发事件对患者的生存至关重要。此外,他们还使用微正电子发射断层扫描和计算机断层扫描了短暂性大脑中动脉闭塞(Middle cerebral artery occlusion, MCAO)脑缺血小鼠模型的主动脉变化,结果发现脑缺血可诱导主动脉等大动脉细胞活性增加,并且 MCAO 小鼠肠系膜血管上髓系细胞(即中性粒细胞和单核细胞)的粘附明显增加,并至少持续到发病后第 28 天(图 2),这表明脑缺血对大动脉有长期影响。
由于内皮细胞是控制免疫细胞运输、血管炎症和动脉粥样硬化的核心,研究人员进一步分析了大动脉中的内皮细胞如何感知和适应脑缺血。基于单细胞转录组测序分析和流式细胞术分析,他们发现 MCAO 小鼠 VCAM1+ ECs 增加,并且其衰老标志物也出现了增加,这表明脑缺血导致了外周远端 ECs 的持续激活和这些细胞的衰老。
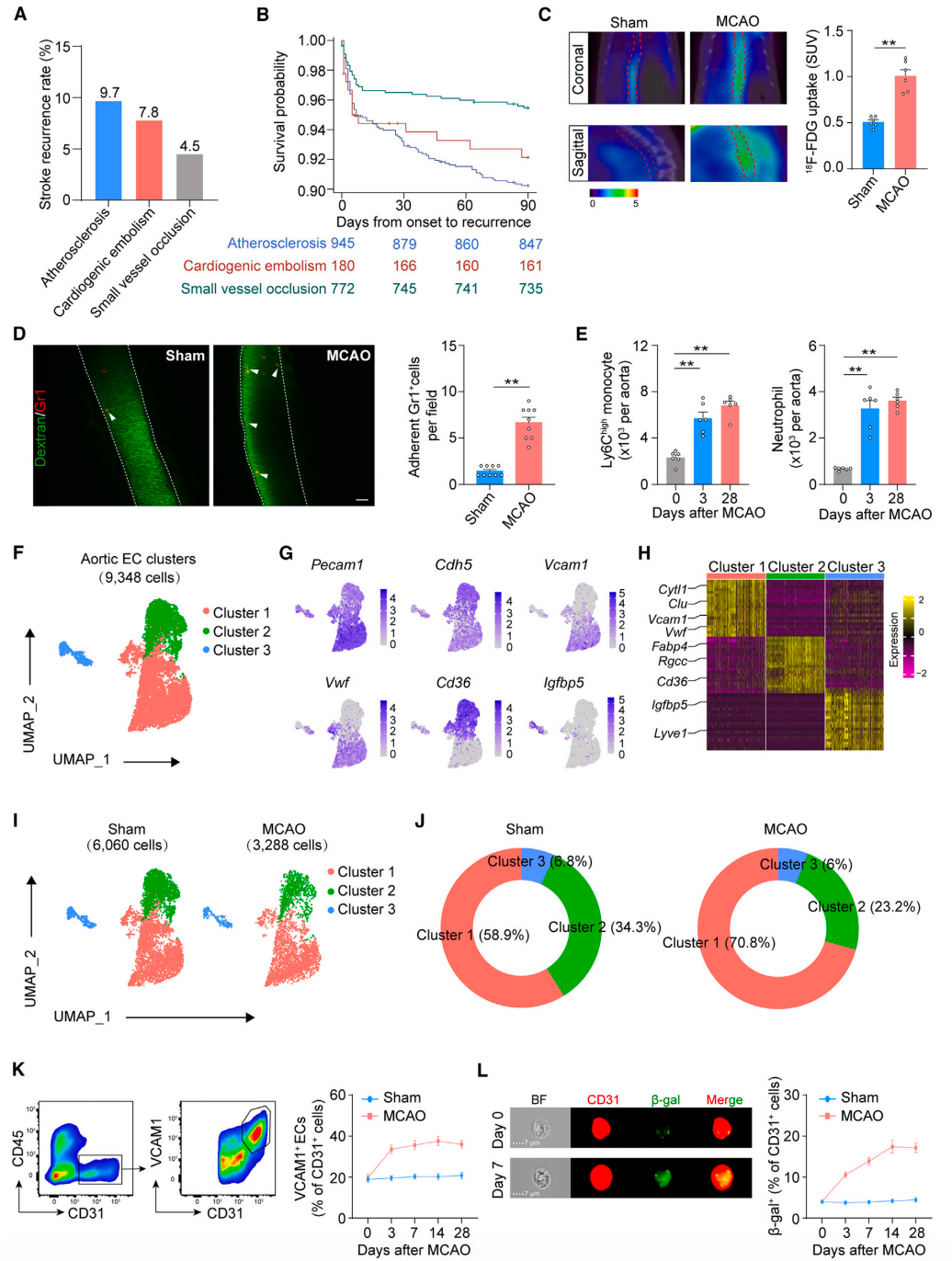
图 2 脑缺血导致外周内皮细胞持续活化和衰老(图源:[1])
2. 脑缺血导致外周内皮细胞持续的 Notch1 激活
脑缺血后 ECs 发生改变的内在驱动因素是什么呢?经过分析,他们观察到,在脑缺血后,无论细胞状态如何,内皮细胞都在与细胞迁移、衰老和细胞粘附相关的通路中富集。值得注意的是,这些通路一致涉及 Notch1 信号通路。进一步的分析发现,Notch1 在脑缺血后的 ECs 中显著上调。流式细胞术分析结果也证实,与对照组相比,MCAO 小鼠主动脉内皮细胞中 Notch1 受体表达上调(图 3)。这些结果表明,脑缺血可导致外周 ECs 持续的 Notch1 激活,这提示血管 ECs 的激活和衰老可能与 Notch1 信号通路有关。此外,在脑缺血事件发生后,外周循环中 Notch1 的配体持续增加。更加有意思的是,他们发现缺血性发生后,患者外周循环的外泌体足以诱导内皮细胞 Notch1 的激活和细胞的衰老。
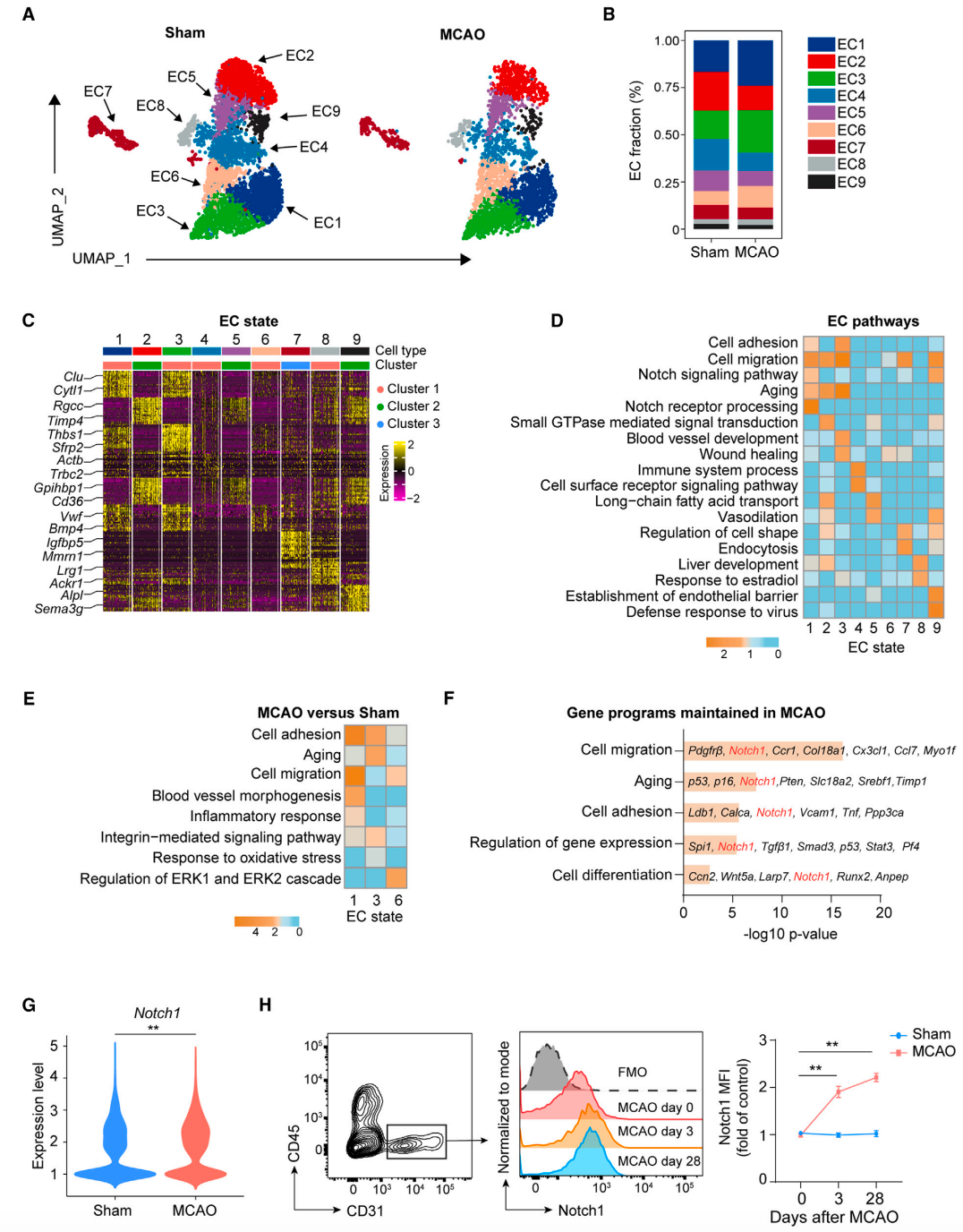
图 3 脑缺血导致外周内皮细胞 Notch 1 持续激活(图源:[1])
3. 内皮细胞 Notch1 的破坏可减轻脑卒中引起的动脉粥样硬化
内皮细胞 Notch1 对动脉粥样硬化有着怎样的影响呢?为了研究 ECs Notch1 的影响,他们构建了小鼠模型,结果发现内皮细胞 Notch1 特异性减少 MCAO 小鼠 ECs 中 VCAM1、P16 和 P53 的表达降低,同时主动脉组织中浸润性单核细胞和中性粒细胞也出现了减少,这表明内皮细胞中 Notch1 的减少缓解了脑缺血引起的内皮粘附性增加、衰老和炎性细胞浸润现象。
为了评估破坏内皮 Notch1 信号通路对脑缺血诱导的动脉粥样硬化和血管炎症的影响,他们利用 apoE 缺失小鼠,并在此基础上构建了内皮细胞 Notch1 特异性减少小鼠。首先,在进行 MCAO 造模手术前就让这些小鼠接受 8 周的高脂肪饮食。随后,他们发现,脑缺血发生后,内皮细胞 Notch1 特异性减少小鼠的整个主动脉和主动脉根的动脉粥样硬化病变减少,单核细胞浸润和油脂氧化阳性区域减少(图 4)。最后,为了测试 Notch1 是否可以作为治疗靶点抑制脑缺血引起的血管炎症,他们用抗 Notch1 单抗进行治疗。流式细胞术分析显示,抗 Notch1 单抗可消除脑卒中诱导的主动脉组织中浸润性单核细胞和中性粒细胞的增加,并且抗 Notch1 单抗还可抑制脑缺血诱导的动脉粥样硬化病变的生长。因此,这些结果表明 ECs Notch1 信号的破坏可抑制脑缺血后动脉粥样硬化的进展。
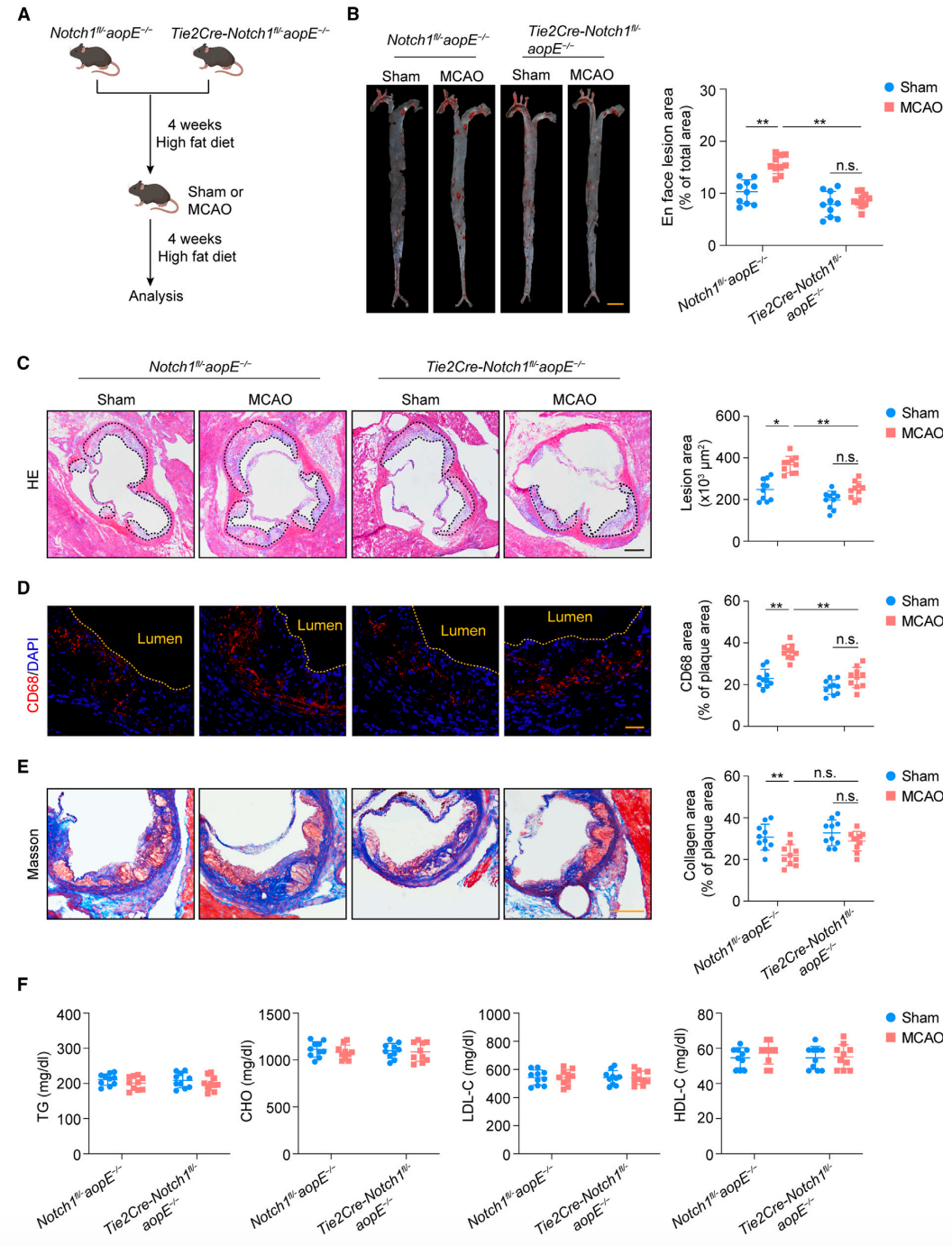
图 4 内皮 Notch1 的破坏缓解了脑缺血诱导的动脉粥样硬化进展(图源:[1])
该研究结果表明,脑缺血导致全身内皮细胞的激活和粘附分子的上调,进而导致单核细胞募集和内皮细胞粘附的增强,最终加速脑缺血后动脉粥样斑块的进展。其中,ECs Notch1 激活的破坏则可抑制这些不利于全身 ECs 变化。总之,该研究揭示了脑缺血发生后外周血管事件复发风险增加的机制,并确定了潜在的治疗靶点。
专家分享
脑卒中防治数据显示,我国高达 40% 的门诊脑卒中患者是复发人群。脑卒中后 1 年 17.1% 的患者再发脑卒中或其他血管性事件,5 年复发率超过 30.0%。脑卒中复发使致残率或死亡风险相对于未复发患者增加约 9.4 倍。即使接受二级预防治疗,脑卒中后 3 个月仍有 3~6% 患者出现复发。因此,针对部分患者无法从已有治疗手段获益这一临床难点,明确脑卒中的复发残余风险对于脑卒中的防治具有重要意义。血管炎症可驱动动脉粥样硬化进展,导致管腔狭窄或斑块脱落形成栓子,是脑卒中复发的主要残余风险之一。然而,脑卒中后发生血管炎症和动脉粥样硬化进展的免疫学机制至今仍不清楚。因此,明确脑卒中的炎症残余风险,推动研究证据向临床指南推荐和转化,是降低这类残余风险,促进脑卒中防治的重点工作方向之一。
血管内皮细胞是血液循环与血管壁之间的重要屏障,不仅维持血管壁完整性,而且感受来自循环血液中的机械和化学刺激。血管内皮细胞激活和免疫细胞粘附是动脉粥样硬化形成和进展的主要原因。脑卒中激活免疫系统,但是目前还不清楚脑卒中对血管内皮细胞和动脉粥样硬化进展的长期影响。
课题组使用脑卒中患者登记队列发现动脉粥样硬化导致的官腔狭窄、斑块脱落造成的栓塞和小血管闭塞是导致脑卒中发病后在 3 个月内复发的主要因素。结合 PET-CT 和结合双光子成像等技术,发现脑缺血造成外周血管内皮细胞处于持续性激活和老化状态,从而上调免疫粘附分子 VCAM1,导致单核细胞和中性粒细胞粘附明显增加。课题组使用卒中患者样本,结合单细胞测序分析和蛋白组芯片检测发现,卒中后受损的脑组织可通过外泌体持续释放 Notch1 受体配体 DLL1 和 Jagged1,激活外周血管内皮细胞 Notch1 通路,造成血管炎症和加速动脉粥样硬化进展。使用抗体药物阻断粘附分子 VCAM1 或 Notch1 受体,可延缓脑卒中后动脉粥样硬化进展(图 5)。在此基础上,课题组提出通过评估脑卒中患者外周血 DLL1 和 Jagged1,预测脑卒中后动脉粥粥样硬化进展的新策略,以及通过靶向粘附分子 VCAM1 和 Notch1 受体的免疫干预,延缓脑卒中后动脉粥样硬化进展的新理念。
以上内容由刘强教授团队分享,刘强课题组专注于脑疾病的免疫机制和临床免疫干预研究,系统揭示了免疫系统在脑卒中和神经免疫疾病等不同类型脑疾病中的病理作用及其干预手段。主持开展了靶向骨髓免疫,治疗脑疾病的多中心临床研究(NCT05154734,NCT05369351,NCT05792462),研发了靶向骨髓免疫新靶点的全人源化 B 细胞刺激因子受体抗体(ZL202311250418.3)和 CAR-T 细胞(ZL20231321640.8),并开展了临床 IIT 研究,有潜力使更多患者获益,具有广阔的应用前景。
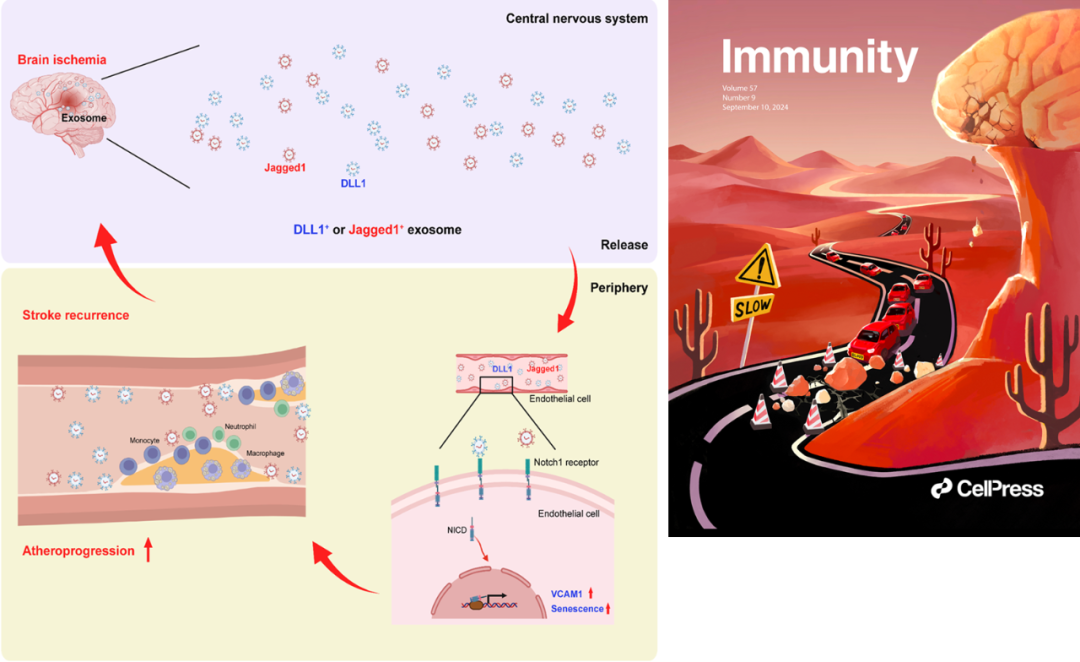 图 5. 脑卒中加速外周动脉粥样硬化进展的模式图(左图:脑卒中后小胶质细胞等脑内细胞释放含有 Notch1 受体配体 DLL1 和 Jagged1 的外泌体,激活外周血管内皮细胞 Notch1 信号通路,导致系统性血管内皮细胞活化和衰老,造成单核细胞和中性粒细胞粘附,从而加速动脉粥样硬化进展,增加脑卒中再发风险。右图:Immunity 封面图候选。脑卒中后脑内的释放含有 Notch1 配体的外泌体好似山上的落石,坠落后导致山路交通堵塞,从而加速动脉粥样硬化进展和卒中复发。 )
图 5. 脑卒中加速外周动脉粥样硬化进展的模式图(左图:脑卒中后小胶质细胞等脑内细胞释放含有 Notch1 受体配体 DLL1 和 Jagged1 的外泌体,激活外周血管内皮细胞 Notch1 信号通路,导致系统性血管内皮细胞活化和衰老,造成单核细胞和中性粒细胞粘附,从而加速动脉粥样硬化进展,增加脑卒中再发风险。右图:Immunity 封面图候选。脑卒中后脑内的释放含有 Notch1 配体的外泌体好似山上的落石,坠落后导致山路交通堵塞,从而加速动脉粥样硬化进展和卒中复发。 )通讯作者:(上下滑动查阅)
刘强,天津医科大学总医院神经内科二级教授、医师,博士生导师,国家杰出青年科学基金获得者、天津市特聘教授。天津医科大学总医院副院长、神经内科癫痫亚专业带头人、天津市免疫学研究所副所长、天津市神经病学研究所副所长。中华医学会脑血管病学组委员、中国医师协会神经修复专委会常委、神经免疫和功能调控学组组长、中国免疫学会理事、中国研究型医院学会神经科学专委会与神经修复专委会副主委、天津市免疫学会副理事长、天津市神经科学会常务理事。代表性成果以通讯作者发表于 Cell、Nature Neuroscience、Immunity、Science Translational Medicine 等期刊。主持开展了靶向骨髓免疫,干预脑卒中和神经免疫疾病的多中心临床研究,揭示了重大脑疾病的免疫机制,使神经免疫学理论取得进展,提出了 「修饰骨髓造血系统,回归免疫稳态,治疗脑疾病」的新理念。曾获 「科学探索奖(医学科学奖)」、「美国心脏协会(AHA)科学家发展奖」、「中国卒中学会论文最佳引用奖」、「天津市自然科学一等奖」、「天津市津门医学英才」、「天津市优秀青年研究生导师」等奖励。
艾玎,教授,博士生导师,长期从事代谢性心血管疾病发病机制的研究,主要研究方向为代谢调节在心血管稳态维持中的分子机制及作用研究,以独立或共同通讯作者身份在 J Clin Invest、Circ Res 及 Hepatology 等学术期刊发表多篇研究性论文,先后获得国家自然科学基金委杰出青年科学基金及教育部***奖励计划青年学者项目等项目的支持。
周洁,天津医科大学基础医学院教授、博士生导师,担任天津市免疫学会理事长、天津市免疫学研究所副所长、中国免疫学会理事等职务,获得国家杰出青年科学基金资助,入选教育部新世纪优秀人才,天津市领军人才,广东省珠江学者等人才计划。主要从事炎症性疾病的免疫机理及转化研究,近年以通讯作者发表 SCI 论文 40 余篇, 包括 Nat Med.、Immunity、Nat Metab.、J Clin Invest.、J Exp Med.、Proc Natl Acad Sci U S A.、Blood、Nat Commun. 等国际知名学术期刊。
参考资料:
Liu et al., Brain ischemia causes systemic Notch1 activity in endothelial cells to drive atherosclerosis, Immunity. 2024. July 29.
我们长期为科研用户提供前沿资讯、实验方法、选品推荐等服务,并且组建了 70 多个不同领域的专业交流群,覆盖 PCR、WB、蛋白研究、免疫学实验、细胞实验、类器官、外泌体、肿瘤研究等,定期分享实验干货、文献解读、同行分享等活动。如果想要获取文献原文,可以添加实验菌企微~
 图片来源:图虫创意如需代发文章宣传、新闻稿、招聘等;或有生物学相关专业背景,有意愿应聘兼职作者的老师,请后台回复【学术】添加小编
图片来源:图虫创意如需代发文章宣传、新闻稿、招聘等;或有生物学相关专业背景,有意愿应聘兼职作者的老师,请后台回复【学术】添加小编