传统的细胞实验往往需要大量的手工操作,培养时间就有一到两周,好不容易到了细胞分离、检测的阶段,又要面临「约流式仪器、分选时间较长、细胞活性损伤」等风险,容易「竹篮打水一场空」。最近做免疫、血液细胞的师弟又在细胞间门口诉苦:

师弟
养了一周的免疫细胞,一做流式死了一大片,又要重新做,啥时候是个头?
流式分选时间长、细胞活性受损,基本没办法回收。你这实验,我用磁珠分选一周能出 2 批结果,导师见了都猛猛夸。

师姐

师弟
这是什么实验?我下午还有一批血液样本要处理,磁珠分选也能做吗?
血液是一种非常复杂的基质,由无数种具有不同功能的细胞组成。使用磁珠针对特定细胞表面抗原的配体或抗体对细胞进行分选或去除,再适合不过了。

师姐
刚做磁珠分选时,可能还会经常遇到细胞回收率、活性等问题。本文整理磁珠实验基本分类以及常见 QA,给你带来二倍速细胞实验体验。同时,我们还准备了有奖调研福利,点此链接或到文末完成调研即可参与抽奖,赢保温杯、自动晴雨伞、京东卡等好礼哦~
磁珠法细胞分离:科研的新利器
磁珠法细胞分离是一种高效、简便的细胞分离技术,广泛应用于生物学和医学研究。通过将磁性微珠与特定抗体结合,利用磁场的作用实现对目标细胞的快速、高效分离。这种方法不仅简化了传统的细胞分离流程,还提高了分离的纯度和速度。
磁珠分选技术主要分为以下几种方法,每种方法都有其特定的应用场景和优势:
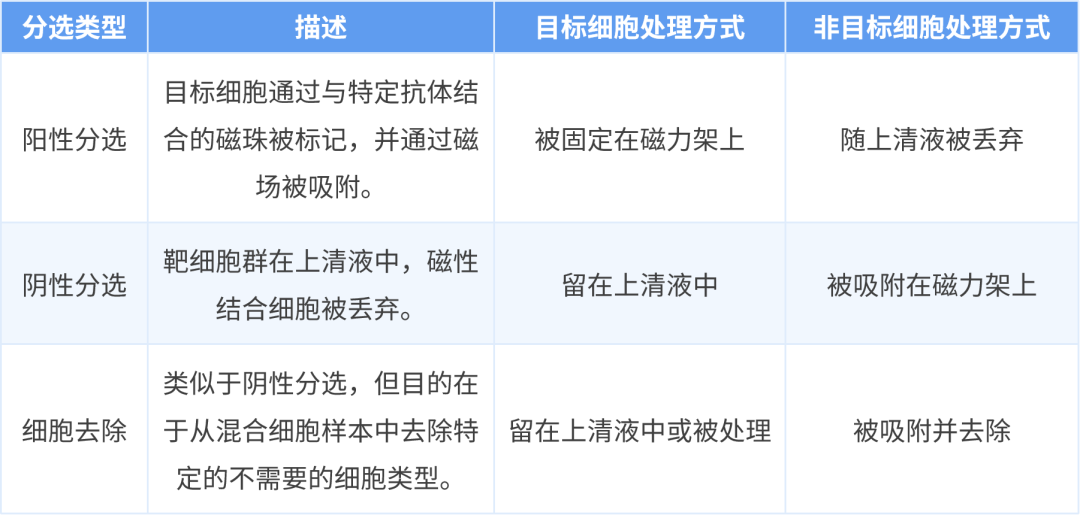
磁珠分选技术可以进行细胞的阳性和阴性分选以及细胞去除。阳性分选时,特定的磁性结合细胞会被固定,直到从磁力架上移除,而上清液则会被丢弃。阴性分选时,靶细胞群在上清液中。对于细胞去除,则是使用细胞特异性磁珠从混合细胞样本中去除特定的不需要的细胞类型。这一技术在 T 细胞等免疫细胞的分离中尤为重要。
Dynabeads™ 磁珠:细胞分离的优选工具
Invitrogen™ Dynabeads™ 磁珠是一种均匀、无孔、单分散的超顺磁性聚苯乙烯微珠,广泛用于各种应用中。这些磁珠具有一致的物理和化学特性,过去 30 多年来,在提供针对免疫系统细胞和其他细胞类型的高性能细胞分离产品方面发挥了重要作用。
在进行 Dynabeads 细胞分离和扩增实验时遇到困难,怎么办?以下 QA 可供科研人员参考:
使用 Dynabeads 磁珠进行阴性分离
Q:有什么提高目标细胞纯度的建议吗?
A:以下是使用 Dynabeads 磁珠进行阴性分离时提高目标细胞纯度的一些建议:
● 良好的回收率和纯度取决于含有少量粒细胞和血小板的高质量 MNC 制备。
● 在混合步骤中可以使用 Invitrogen™ HulaMixer™ 样品混匀器(货号 15920D),确保抗体与目标细胞充分结合。
● 在抗体结合步骤后充分清洗细胞,以去除未结合的抗体。
● 2 次重复方案可在不增加分离中使用的 Dynabeads™ 磁珠数量的情况下提高纯度。
Q:能否提供一些提高最终回收率/产量的建议?
A:以下是使用 Dynabeads 磁珠进行阴性分离时提高最终回收率/产量的一些建议:
● 样品制备:所有分离都必须在单细胞悬浮液中进行。
● 确保使用正确的细胞数、稀释度以及抗体混合物、Dynabeads™ 磁珠和缓冲液的体积。
● 在混合步骤中可以使用 Invitrogen™ HulaMixer™ 样品混匀器(货号 15920D),以确保分离过程中的充分混合。
● 在最后一个步骤中,细胞/磁珠颗粒在放置到磁力架上之前必须用 1 mL 移液管充分重悬 > 10 次。这样做是为了捕获可能被困在细胞团中的目标细胞。
● 用于制作分离和洗涤缓冲液的 PBS 应不含 Ca2+ 和 Mg2+,以避免补体活化和细胞聚集。
Q:在使用 Dynabeads 磁珠进行单核细胞阴性分离时,发现了聚集现象。该怎么办?
A:在分离单核细胞时,活化的血小板会与单核细胞结合,产生不利的单核细胞和血小板聚集。引发血小板活化的因素有多种,如温度变化、机械因素(如剪切力)、接触抗凝剂肝素(通常存在于采样管中)等。为避免血小板活化(以及随后的单核细胞聚集),应遵循以下几项一般建议:
● 使用肝素以外的抗凝剂(如 ACD、EDTA 或柠檬酸钠)。
● 在制备 MNC 之前,血液样本应保存在室温下,MNC 制备本身也应在室温下进行。
● 样本处理时应轻柔,尽量减少机械剪切。如果可能,应使用注射器/针头手动抽血,而不是 Vacutainer™ 管,因为这种采样管中的真空往往会导致血小板和单核细胞活化。
● 众所周知,柠檬酸钠能「稳定」血小板并防止活化,除了作为抗凝剂的缓冲柠檬酸盐溶液外,柠檬酸钠还含有茶碱、腺苷和双嘧达莫。
● 请遵循我们的 MNC 制备方案,因为该方案旨在获得血小板数量较少的 MNC。
上下滑动查看更多
使用 Dynabeads 磁珠进行阳性细胞分离
Q:DETACHaBEAD™ 磁珠溶液看起来浑浊,这正常吗?
A:浑浊是 DETACHaBEAD™ 磁珠的正常现象,因为蛋白质含量很高,蛋白质会沉淀。这并非细菌污染,不会影响分离和释放细胞的回收或活力。使用前请彻底混合溶液。
Q:能否提供使用 DETACHaBEAD™ 磁珠时提高细胞产量的技巧?
A:这里有一些建议:
● 使用前充分混合 DETACHaBEAD™ 溶液。
● 孵育步骤中磁珠与样品的混合是获得高产量的关键参数。我们建议使用混合器或旋转器(如 HulaMixer™ 样品混合器(货号:15920D)),使试管持续运动,但要使样品停留在试管底部,以避免珠子干燥。
● 在细胞分离过程中缩短孵育时间(较低的结合亲和力可提高释放效率)。
● 用 DETACHaBEAD™ 磁珠孵育后,在使用磁力架之前,用移液管上下吹打与磁珠结合的细胞至少 10 次,以尽可能多地将磁珠从细胞上移除。过于用力的移液会降低细胞存活率。
● 在操作过程中避免不必要的延迟。
Q:使用任何 Dynabeads 阳性分离试剂盒分离细胞时,如何提高细胞产量?
A:以下是一些建议:
● 样品制备非常重要。所有分离都必须在单细胞悬浮液中进行。对于直接从全血中分离某些类型的细胞(如单核细胞),建议您在分离前清洗血液,以去除样品中的干扰因素。
● 所有指定「混合」的孵育都必须使用适当的混合器。可使用任何可倾斜旋转或端端混合的混合器(如 HulaMixer™ 样品混匀器(货号 15920D))。
● 如果使用 FlowComp™ 试剂盒,先在细胞中加入抗体,然后再加入磁珠(间接法),则应在加入磁珠前通过洗涤去除多余的抗体。
● 使用释放剂孵育后,建议使用 1 mL 移液管吹打 > 10 次,重新悬浮样品,然后再将样品放置在磁力架上。
● 细胞分离必须使用推荐的分离缓冲液。PBS 必须不含 Ca2+ 和 Mg2+,因为这些二价离子会导致补体激活和细胞聚集。
● 样本中的细胞聚集会严重降低分离的产量和纯度。
Q:能否提供一些提高 Dynabeads™ FlowComp™ 细胞分离试剂盒释放效率的建议?
A:以下是一些建议:
● 由于 DSB-X 生物素-链霉亲和素键会随着时间的推移而变强,因此释放步骤的时间不要超过方案中规定的时间。在某些情况下,缩短孵育时间可提高产量。
● 使用释放剂孵育后,建议使用 1 mL 移液管吹打 > 10 次,重新悬浮样品,然后再将样品放置在磁力架上。
Q:如果找不到适合的细胞类型的 Dynabeads 阳性分离试剂盒,该怎么办?
A:推荐将 Dynabeads™ FlowComp™ Flexi 试剂盒与合适的目标抗体结合使用,进行细胞分离。Flexi 试剂盒包含用于抗体生物素化的 DSB-X 生物素化试剂盒、经修饰的链霉亲和素包被的 FlowComp™ Dynabeads™ 磁珠以及进行分离和释放所需的 FlowComp™ 释放缓冲液。
Q:能否提供一些改进 CELLection™ 释放步骤的小技巧?
A:以下是一些建议:
● 确保 RPMI + 1% FBS 的 pH 值不要太高:DNase I 在 pH 7.0~7.4 之间效果最佳(RPMI 中的氧气会导致 pH 值升高,pH 指示器会变蓝)。
● 在 DNase I 处理过程中,不要使用 RPMI + 10% FCS。10% FBS 的细胞产量比 1% FBS 的细胞产量低(可能是由于某些批次的 FBS 中含有抑制 DNase I 的因子)。
● 确保缓冲液中含有 DNase 活性所需的 Mg2+/Ca2+ 。
● 必须温和处理 DNase I。剧烈搅拌 DNase 溶液会降低酶的活性。切勿搅动 DNA 酶溶液。
● 分选少量细胞时,建议使用 RPMI + 10% FBS 预涂试管,以减少细胞丢失(细胞有粘性,在分选过程中容易附着在管壁上)。
● DNase I 在 20 °C 时有很好的活性,建议在开始 DNase I 处理前将 RPMI + 1% FBS 预热到 37 °C,因为不同实验室的「室温」不同。
● 用 DNase 释放缓冲液培养细胞后,必须在磁分离前用移液管彻底吸出磁珠-细胞复合物,以便对 DNA 连接体进行机械破坏。如果不对细胞进行移液,将影响细胞产量。
Q:在使用 CELLection™ 生物素结合剂试剂盒或 CELLection™ Pan Mouse IgG 试剂盒时,能否提供一些提高产量的建议?
A:以下是一些建议:
● 包被 CELLection™ Dynabeads™ 磁珠时,滴定/优化目标抗体量。
● 如果目标细胞数量少或细胞表面的目标抗原浓度低,请使用间接法。
● 每毫升样本(> 25 μL)一定要使用 > 1 x 107 磁珠。
● 使用前清洗全血。
● 为确保最有效地释放细胞,重新悬浮冻干 DNase 时切勿涡旋 DNase。
● 细胞释放时,使用预热至 37 °C 的新鲜 RPMI/1% FCS。
● 检查 RPMI 的 pH 值。应为 7.0~7.4。较高的 pH 值会抑制 DNase 的活性。
● RPMI 应含有足够的 Mg2+ 以保证 DNase 的活性。
● 用 DNase 释放缓冲液孵育细胞后,必须在磁分离前用移液管彻底吸出磁珠-细胞复合物,以便对 DNA 连接体进行机械破坏。如果不对细胞进行移液,将影响细胞产量。
上下滑动查看更多
使用 Dynabeads 磁珠进行细胞活化和扩增
Q:在扩增 T 细胞时,细胞在使用 Dynabeads™ 磁珠激活后死亡?这是为什么?
A:这里有几个保持最佳细胞培养生长条件的小窍门:
● 细胞密度必须保持在 0.5~1.5 x 106 细胞/mL ,以获得最佳生长状态。当细胞密度超过 1.5~2.5 x 106 细胞/mL 时,需要重新刺激。
● 每隔 8~12 天重新刺激一次,磁珠与细胞的比例请参照产品手册。
● 根据产品手册,针对每种特定产品使用正确的磁珠与细胞比率进行活化。过多的磁珠会抑制细胞活化/增殖。
● 使用优化的细胞培养基,添加
生长因子(IL-2、IL-7、IL-15 或其他细胞因子)
促进生长的补充剂(如人血清/FBS、L-谷氨酰胺/谷氨酰胺、自由基清除剂(10 mM N-乙酰半胱氨酸)
上下滑动查看更多
通过这些策略和解决方案,大家可以更有效地利用磁珠分选,推动细胞生物学和免疫学研究课题的进展,拒绝反复操作,不再做科研民工。如你正在做磁珠分选,那千万不要错过本次有奖调研,现点击下方图片或扫描二维码完成简单调研即可参与抽奖,赢保温杯、自动晴雨伞、京东卡等好礼哦~
👇👇👇

内容策划:邹礼平
内容审核:吴军
题图来源:图虫创意