来源:丁香学术
同源重组修复(homologous recombination repair,HRR)是细胞中 DNA 双链断裂后主要的修复方式。同源重组修复缺陷(homologous recombination deficiency,HRD)指细胞水平上的 HRR 功能障碍,通常由 HRR 相关基因胚系突变或体细胞突变以及表观遗传失调等诸多因素导致,常存在于卵巢癌、乳腺癌、胰腺导管癌、前列腺癌等多种恶性肿瘤中,在卵巢癌中 HRD 比例高达 50%[1]。
多聚腺苷二磷酸核糖聚合酶(poly(ADP-ribose) polymerase,PARP)是应激条件下参与 DNA 修复的关键酶。作为 DNA 损伤的分子感受器,PARP 具有识别、结合到 DNA 断裂位置的功能,进而激活、催化受体蛋白的聚 ADP 核糖基化作用,参与 DNA 的修复过程。PARP 对于细胞的稳定和存活非常重要,PARP 失活则会加速细胞的不稳定。在临床上,多种 PARP 抑制剂已被批准用于卵巢癌、乳腺癌、前列腺癌和胰腺癌的治疗,主要是通过抑制 PARP 酶活性来杀死肿瘤细胞,尤其是在 HRD 的肿瘤中更具有显著疗效,这种基于 PARP 抑制剂的化学疗法被称为 PARPi 疗法[2]。尽管最近的研究已经开始揭示 HRD 与人类癌症 (包括卵巢癌) 的肿瘤微环境(Tumor Microenvironment,TME)之间的相互作用,但解码 HRD 和 PARP 抑制对 TME 的相互作用仍然是重中之重。
2024 年 7 月 5 日,华中科技大学同济医学院附属同济医院高庆蕾教授、方勇教授、马丁院士联合德克萨斯大学 MD Anderson 癌症中心梁晗教授等团队在 Cell 发表研究。通过对 127 例高级别浆液性卵巢癌(High-Grade Serous Ovarian Cancer,HGSOC)样本进行单细胞和多模态分析,强调了以效应性 Treg 细胞为重点的治疗 HGSOC 和其他 HRD 相关肿瘤疾病的潜力,为临床上通过 PARP 抑制剂治疗卵巢癌提供指导。

图 1 相关研究(图源:[3])
绘制新辅助治疗下 HGSOC TME 的单细胞图谱
为了研究 HRD、新辅助治疗及其相互作用对 TME 的影响,研究人员在 II 期临床试验 (NCT04507841) 中招募了未接受治疗的新诊断为不可切除的 HGSOC 患者,为他们进行辅助性尼拉帕尼单药治疗 (neoadjuvant niraparib monotherapy,NANT) 或辅助性化疗(NACT)。治疗结果表明,NANT 是控制 HRD 合并 HGSOC 患者疾病进展的有效治疗选择。选择经 NANT 治疗前后的 24 对肿瘤样本作为单细胞 RNA 测序的队列,计算整合大于 62 万个细胞,并将他们划分为 10 种细胞类型进行后续分析。此外,研究人员还对患者的外周血进行了 scRNA-seq/TCR-seq、多重免疫组织化学 (mIHC)、流式细胞术分析和大量 TCR-seq,最终形成了大规模、多模态的高质量数据集,以阐明肿瘤的 HRD 状态以及治疗如何影响卵巢癌的 TME。
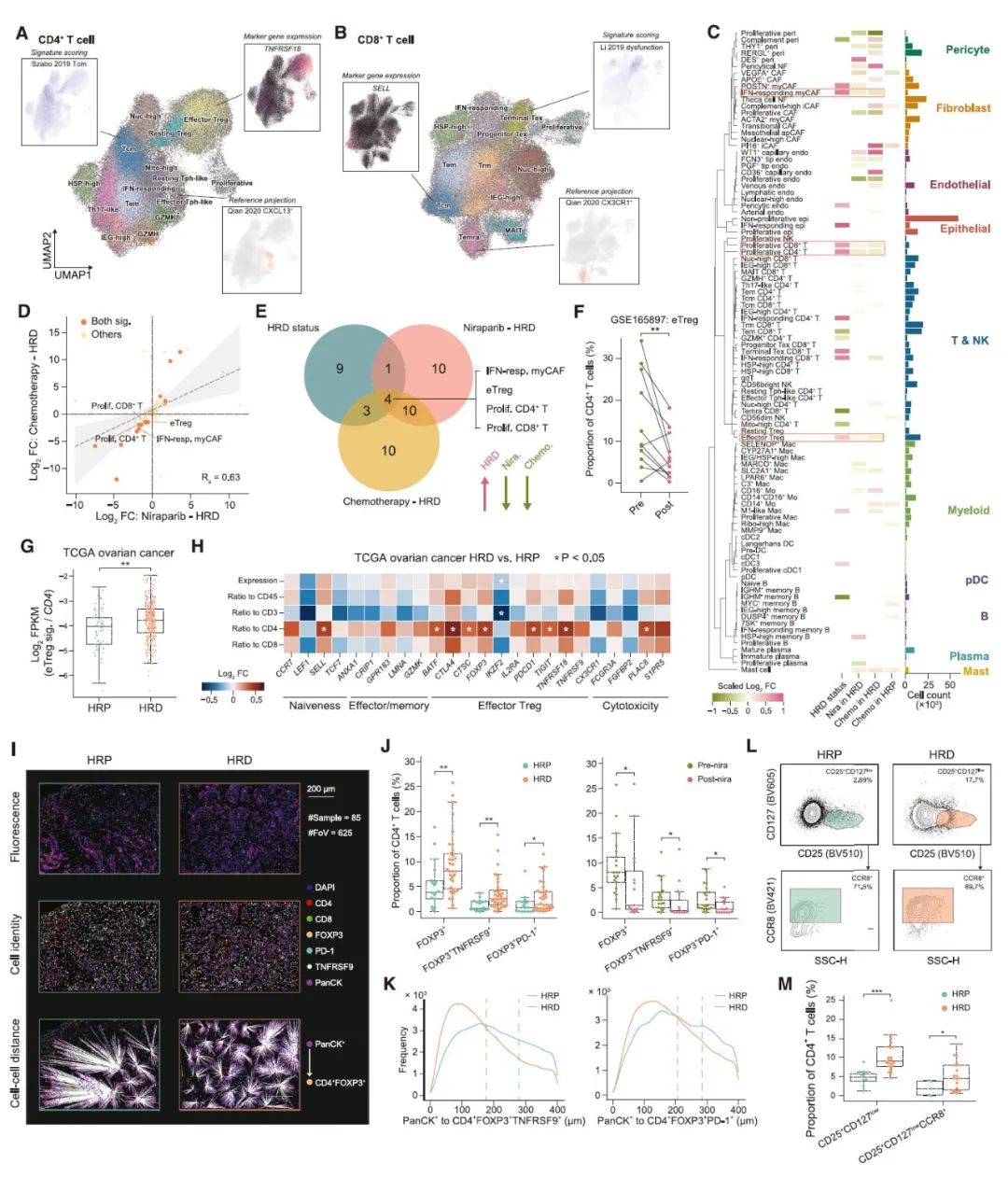
图 2 绘制新辅助治疗下 HGSOC TME 的单细胞图谱(图源:[3])
新辅助治疗优先抑制 HRD HGSOC TME 中的 eTregs 细胞
治疗前后究竟是哪群/类细胞发生了变化呢?通过分析比较测序结果,研究人员发现干扰素应答的 myCAFs,效应调节性 T 细胞 (eTregs) 和增殖性 CD4+/CD8+ T 细胞在治疗初期 HRD TME 中丰度较高,而在治疗后 HRD 肿瘤中丰度降低。鉴于 Treg 是数据集中最丰富的 T 细胞群,且 eTreg 亚群具有免疫抑制功能,后续则主要对 eTreg 细胞群进行分析验证。通过对已发表 scRNA-seq 队列分析、TCGA 数据库分析、免疫组化检测以及流式细胞术分析,表明新辅助治疗后最显著的变化是 HRD 富集的 eTregs 明显减少(图 3)。进一步分析表明 HRD 和新辅助疗法导致肿瘤 TME 中 eTregs 通过与 CD4+ T 细胞增殖池不断交换,具有强大但受肿瘤限制的自我扩张能力,而同样由肿瘤诱导的 Texs 则来自多个效应 CD8+ T 细胞子集。
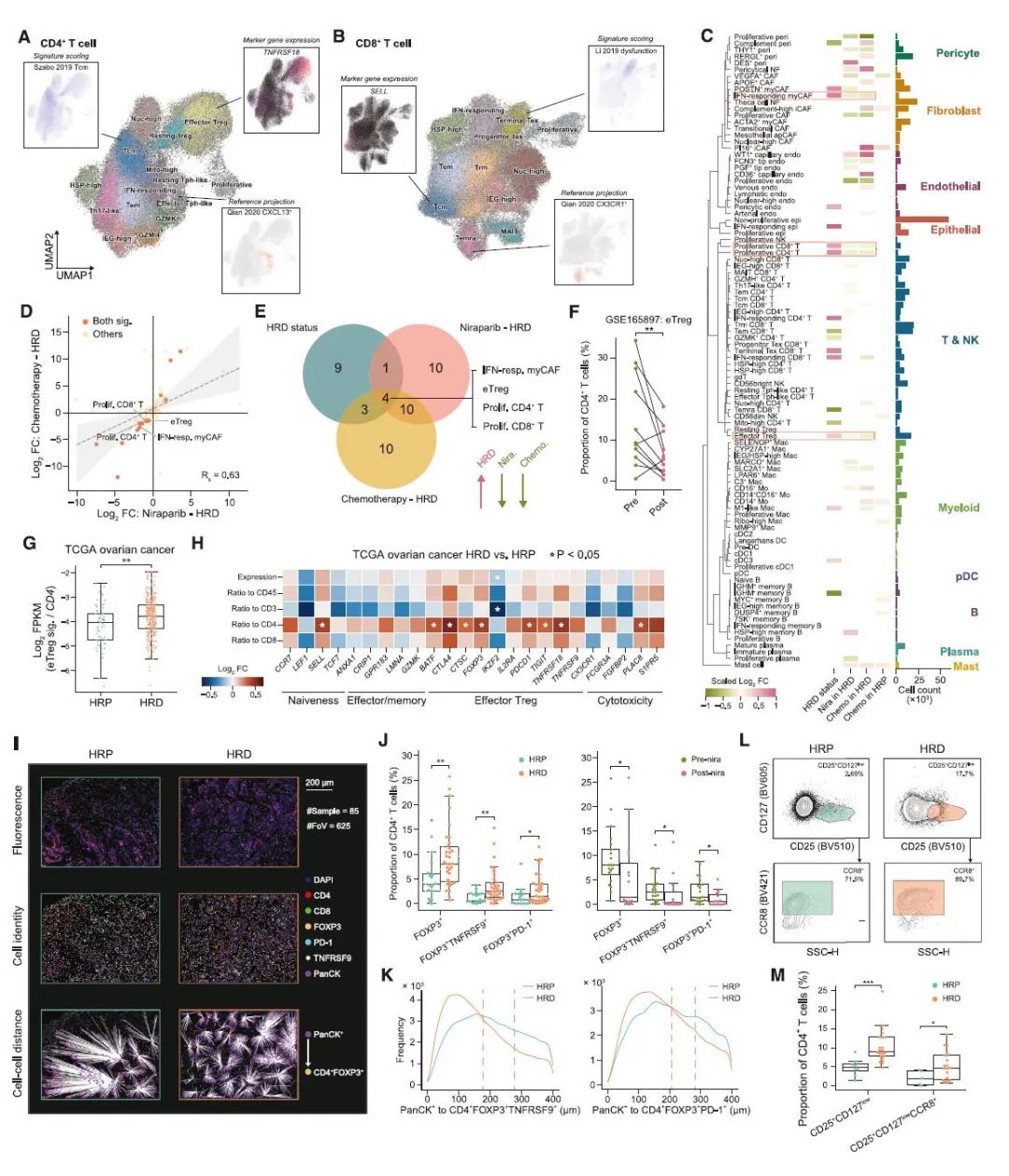
图 3 新辅助治疗优先抑制 HRD HGSOC TME 中的 eTregs 细胞(图源:[3])
TME 干扰素信号的变化与 HRD 相关的 eTreg 富集呈正相关
进一步地,研究人员发现治疗后 TME 中发生明显数量变化的 eTregs 和 Texs 中均以激活 IFN 信号为标志。通过比较抗原呈递系统表达水平,发现 IFN 通过激活 MHC I 类和 MHC II 类基因的主调控因子 CITA 和 CIITA 来上调 MHC I 类和 MHC II 类基因表达的作用,干扰素诱导的 HRD 肿瘤细胞中 MHC II 类表达可能有助于 eTregs 富集,这一结论在多种卵巢癌和乳腺癌细胞系中得到验证。
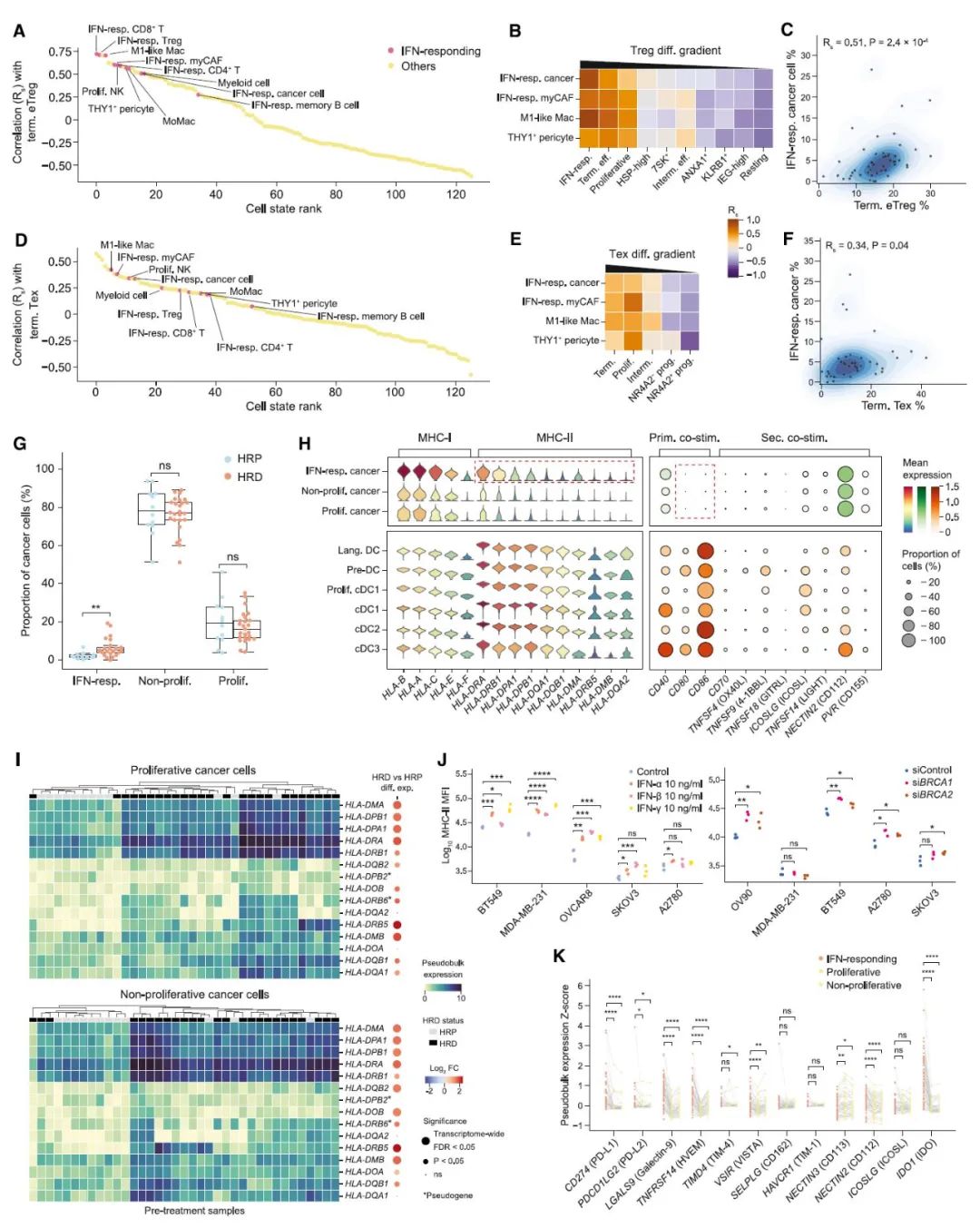
图 4 TME 干扰素信号的变化与 HRD 相关的 eTreg 富集呈正相关(图源:[3])
联合靶向 PARP 和 eTregs 治疗 HRD HGSOC 肿瘤具有较好疗效
HRD 肿瘤治疗后 eTregs 显著减少可以指导临床治疗吗?研究人员利用人源化治疗性单克隆抗体 ZL-1218(目前已在 I 期临床试验中用于治疗晚期实体瘤)靶向 eTreg 标记物 CCR8。为了评估其疗效,通过向人源化 ccr8 (hCCR8) 小鼠中注入带有 CRISPR 编辑的 Trp53 和 Brca1 的 ID8-Luc 细胞,构建了原位 HGSOC 小鼠模型,与肿瘤患者中表现一致,HRD trp53 缺失的小鼠肿瘤中 eTreg 和末端 Texs 的比例明显高于 HRP 对应的肿瘤。接着,在移植 2 周后给荷瘤小鼠施用 PARP 抑制剂尼拉帕尼和/或 CCR8 单抗,虽然单独使用尼拉帕尼或 CCR8 单抗可以减缓肿瘤进展,但它们联合使用显示出更明显的抑制作用。重要的是,出血性腹水的发展作为卵巢癌的致命标志被联合治疗显著遏制。其他 Tregs 消耗疗法也显示出与 PARP 抑制相结合类似的抗肿瘤效果。
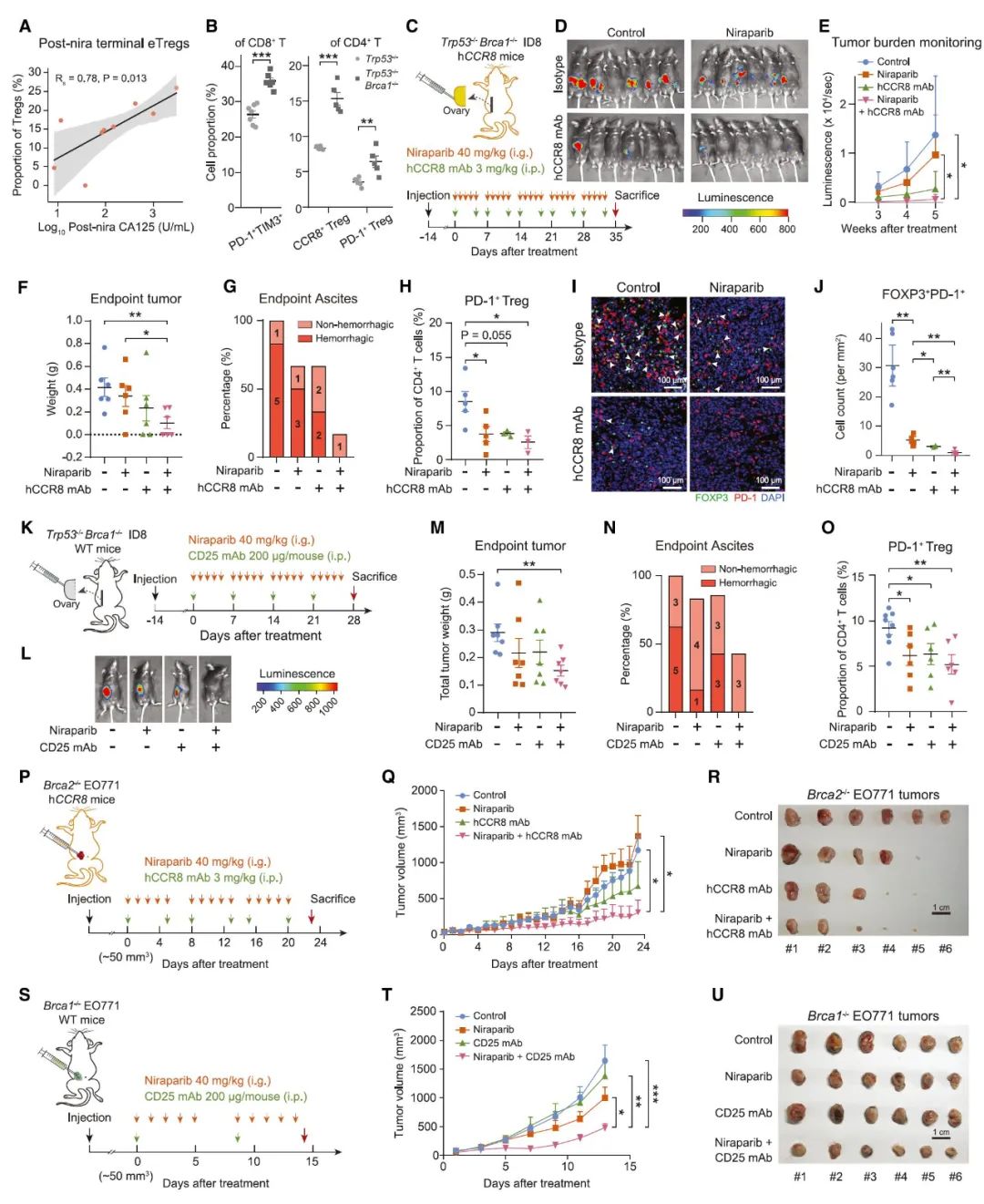
图 5 联合靶向 PARP 和 eTregs 治疗 HRD HGSOC 肿瘤具有较好疗效(图源:[3])
总体而言,本项研究通过对治疗前后的 HGSOC 肿瘤样本进行单细胞基因表达和 T 细胞受体多模态数据分析,发现效应调节性 T 细胞 (eTregs) 与 Texs 细胞共同作为 HRD 和新辅助治疗的关键应答者,干扰素信号通过上调 MHC-II 类分子等诱导 Tregs 和 Texs 富集。此外,在有或没有 PARP 抑制的 HRD 小鼠模型中,消耗 eTreg 可显著抑制肿瘤生长而无明显毒性,这项工作突出了以 eTreg 为靶点的治疗 HGSOC 和其他 HRD 相关肿瘤的潜力。
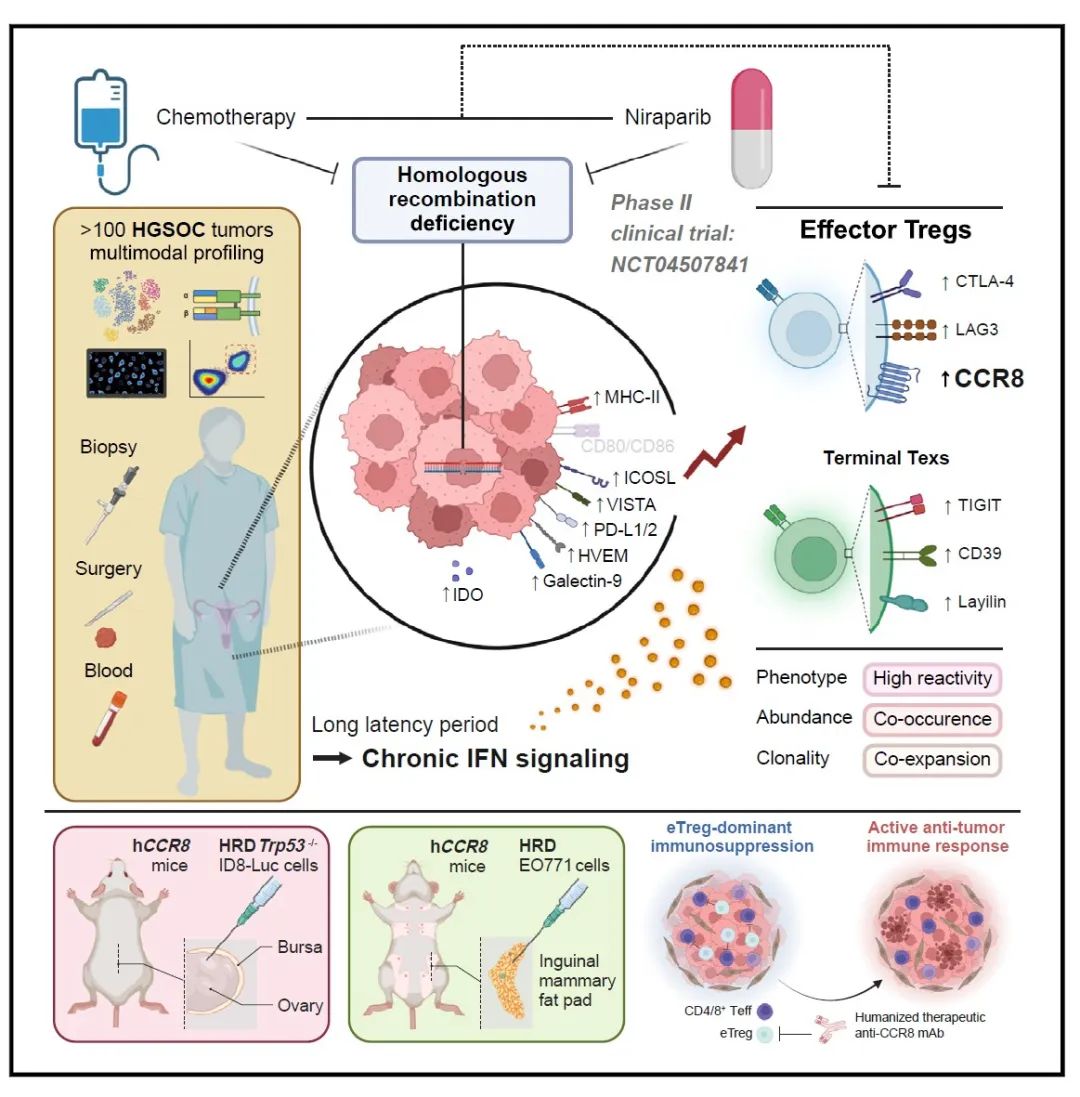
图 6 全文图解(图源:[3])
作者简介
高庆蕾:华中科技大学同济医学院附属同济医院妇科肿瘤科主任,教授,博士生导师。长期从事卵巢癌的精准诊疗和临床转化,擅长妇科恶性肿瘤等困难的腹腔镜微创和开腹手术治疗,年手术量近千台(IV 级手术占比 70%);执笔撰写妇科肿瘤前沿领域 PARP 抑制剂、免疫检查点抑制剂等 6 项临床指南和共识。主持科技部十四五重点研发计划和国家自然科学基金 6 项,授权发明专利 7 项,在包括 Lancet Digit Health、 J Exp Med(入选该杂志年度 Top 10 文章)、 Nat Commun(2 篇)、 Mol Cancer、STTT、Clin Cancer Res(2 篇)、 Cancer Res 和 Autophagy 等期刊发表 SCI 论文 142 篇, IF>10 分 24 篇,累计影响因子 1235.9。以第一完成人获得中华医学科技一等奖和全国妇幼健康自然科学一等奖各 1 项,临床转化成果荣登 2021「科创中国」先导技术榜(生物医药领域),荣获 IDC(跨界国际信息技术机构)中国数字化转型「领军人物奖」、全国「荣耀医者」等奖励。
方勇:华中科技大学同济医学院附属同济医院副主任医师,教授,博士生导师。入选国家海外高层次人才,湖北省百人,武汉市「武汉英才」产业领军人才。2016 年-2020 年先后在美国 MD 安德森癌症中心和美国俄勒冈州奈特癌症研究中心从事卵巢癌精准治疗的设计和机制研究工作。研究成果在 Cancer Cell, Science Translational Medicine, STTT,Autophagy, Leukemia 等杂志上发表,其中一篇以特载文章(Featured article)形式在 Cancer Cell 杂志发表,首次提出卵巢癌序贯应用 PARPi 的概念,并进入 II 期临床研究。主持国自然科学基金 4 项、作为研究骨干参与和撰写国家重大规划项目 1 项、重大项目 1 项、重点项目 1 项、面上和青年项目 12 项。
马丁:中国工程院院士,华中科技大学同济医学院附属同济医院教授、妇产科学系主任,国家妇产疾病临床研究中心主任,中华医学会妇科肿瘤学分会第六届委员会名誉主任委员、中国医疗保健国际交流促进会常务理事、妇儿医疗保健分会主任委员。擅长妇科肿瘤及普通妇科疾病的诊断和治疗,精于妇科手术、腔镜及机器人手术,同时在妇科肿瘤防治和肿瘤转移及转化医学等临床科学研究方面有较高造诣。中华医学会妇科肿瘤学分会前任主任委员;现任国家妇产科重点学科主任、国家妇产疾病临床研究中心主任。长期从事宫颈重大疾病的遗传易感性、宫颈癌早期预警和精准防治筛查领域的研究,相关工作发表于Nature Genetics、Nature Genetics、Nature Communication、Journal of Clinical Investigation、Journal of Experimental Medicine、Cancer Research、STTT等国际高水平期刊。研究成果以第一完成人获得2010年和2012年国家科技进步奖二等奖。
梁晗:德克萨斯大学MD安德森癌症中心生物信息与计算生物学系教授,副系主任,同时兼系统生物学系教授。2001年毕业于北京大学化学系获理学学士,2006年毕业于美国普林斯顿大学获博士,2009年加入MD安德森癌症中心开始独立教职。目前他的研究方向为人工智能在癌症组学大数据分析的应用和肿瘤精准治疗。主要关注点为:开发先进的生物信息算法和工具;泛癌综合分析;癌症进化,癌症RNA调控和修饰;癌症系统生物学方法,研究成果发表于Cell、Cancer Cell、Nature Biotechnology、Nature Methods、Nature Genetics等国际高水平期刊,总被引超30000次。梁晗教授是美国政府大型科研项目的首席科学家,担任国际癌症基因组联盟(ICGC)多种癌症全基因组共同领导人,美国癌症基因图谱(TCGA)泛癌分析科学组主席,美国国家癌症研究所(NCI)基因组数据库质控组共同主席,担任Cancer Cell和Genome Biology编委。
我们长期为科研用户提供前沿资讯、实验方法、选品推荐等服务,并且组建了 70 多个不同领域的专业交流群,覆盖 PCR、WB、蛋白研究、免疫学实验、细胞实验、类器官、外泌体、肿瘤研究等,定期分享实验干货、文献解读、同行分享等活动。如需进群,可以先加实验菌企微哦~
 图片来源:图虫创意如需代发文章宣传、新闻稿、招聘等;或有生物学相关专业背景,有意愿应聘兼职作者的老师,请后台回复【学术】添加小编
图片来源:图虫创意如需代发文章宣传、新闻稿、招聘等;或有生物学相关专业背景,有意愿应聘兼职作者的老师,请后台回复【学术】添加小编参考文献
[1] Rempel, E., Kluck, K., Beck, S., Ourailidis, I., Kazdal, D., Neumann, O., Volckmar, A.L., Kirchner, M., Goldschmid, H., Pfarr, N., et al. (2022). Pan-cancer analysis of genomic scar patterns caused by homologous repair deficiency (HRD). NPJ Precis. Oncol. 6, 36.
[2] Groelly, F.J., Fawkes, M., Dagg, R.A., Blackford, A.N., and Tarsounas, M. (2023). Targeting DNA damage response pathways in cancer. Nat. Rev. Cancer 23, 78–94.
[3] Luo et al.Neoadjuvant PARPi or chemotherapy in ovarian cancer informs targeting effector Treg cells for homologous-recombination-deficient tumors.Cell.2024