导师
近期发现实验室里有人专做「经费小偷」!肿瘤细胞做个外泌体提纯,几个月了,什么都没提取出来还浪费了珍贵样本。小李,说的就是你,再来一次你就等着延毕吧!
可我也是按照 protocol 一步步提取的,白天离心机排不上队,还加班熬夜离心了好多次,结果不是纯度差就是得率低,我也很无奈……

小李
提取纯化外泌体常用的差速离心法是利用从 3,000 g 到 100,000 g 的多次离心循环来分离密度、大小和质量一定区间内的物质。如果样本自身的细胞碎片多或者外泌体浓度很低,确实很难拿到纯度高得率足够的外泌体,而且离心的过程多少也会影响外泌体的活性和完整性。

那么如何快速提纯外泌体?可以考虑宇玫博最新研发的提取方式!无需借助离心机,利用层析法仅需 1 h 即可实现更高纯度的外泌体提纯,得率也毫不逊色。更适用于细胞培养上清液、尿液等非粘稠性样本中的外泌体提取纯化。好不好用,试过才知道,点击下方图片或扫码,即可免费申请试用~

点击下方图片免费申请试用


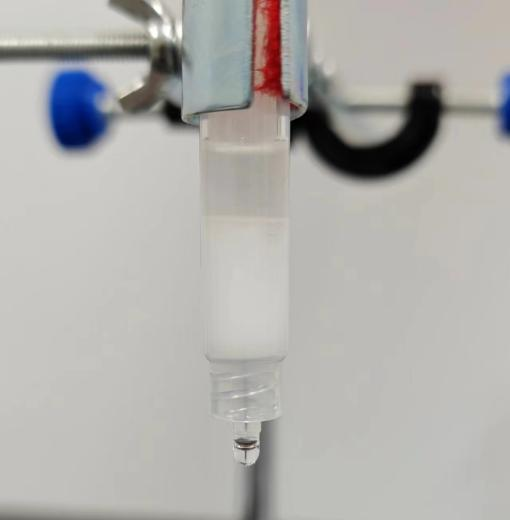
1 h 快速外泌体提纯法实验流程
操作视频
详细操作步骤
一、样品预处理
1、取样:如果是冻存样品,从冰箱取出后置于 4 ℃ 解冻,融化后置于冰上;如果是新鲜样品,收集样品后直接置于冰上;
2、样品处理量(单个柱子处理量):

注:每个「Exosome Extraction Column」处理量 10~20 mL(未经浓缩的原始上清),样品过少可能导致获得的外泌体浓度低,样品过多可能导致堵柱。
3、离心去细胞:样品于 4 ℃ 以 300 ×g(~1,640 rpm**)离心 5 min,去除样品中的细胞;**为约 10 cm 有效离心半径的大离心机换算(≥ 15 mL 离心管),下同。
4、离心去细胞碎片:将去除细胞后的样品于 4 ℃ 以 3,000 ×g(~5,200 rpm**)离心 10 min,去除样品中的细胞碎片(注:若沉淀较多,可 3,000 ×g,10 min 离心多次至无明显沉淀,每次取离心上清液);
5、上清液过滤:去除细胞碎片的离心上清液用 0.45 μm 或 0.22 μm 过滤器过滤至新的容器中。
上下滑动查看更多
二、提取前准备
1、固定外泌体提取柱(Exosome Extraction Column):取出提取柱,将提取柱上下筛板取下后垂直固定于试管架或铁架台上,待填料保存液自然流尽;
2、加入 Solution A 溶液:填料保存液流尽后沿柱子内壁缓慢加入 5 mL Solution A 溶液,待 Solution A 溶液自然流尽;
3、加入 Solution B 溶液:Solution A 流尽后沿柱子内壁缓慢加入 5 mL Solution B 溶液,待 Solution B 溶液自然流尽,等待上样。
三、提取外泌体
1、过柱:将经 0.45 μm 或 0.22 μm 过滤器过滤后的细胞上清液沿柱子内壁缓慢多次加入提取柱中,待细胞上清液自然流尽(注:每个「Exosome Extraction Column」上样量 10~20 mL(未经浓缩的原始上清),样品过少可能导致获得的外泌体浓度低,样品过多可能导致堵柱);
2、平衡:细胞上清液流尽后沿柱子内壁缓慢多次加入 15 mL Solution B 溶液,待 Solution B 溶液自然流尽;
3、洗杂:Solution B 溶液流尽后沿柱子内壁缓慢加入 0.8 mL Solution C 溶液,待 Solution C 溶液自然流尽;
4、洗脱:待上步骤中 Solution C 溶液流尽后沿柱子内壁再次缓慢加入 1 mL Solution C 溶液,收集该流穿液(该流穿液中富含外泌体颗粒);
5、浓缩(选做):若外泌体浓度过低,可用 100 KD 超滤柱将流穿液适当浓缩;
6、纯化外泌体:将收获的外泌体颗粒粗品转入 Exosome Purification Filter(EPF 柱)上室中,于 4 ℃ 以 3,000 ×g(~6,200 rpm*)离心 10 min,离心后收集 EPF 柱管底的液体,此液体即为纯化后的外泌体(注:EPF 柱不可重复使用);*为约 7 cm 有效离心半径的小离心机换算(≤ 2 mL 离心管)。
7、外泌体的保存:纯化后的外泌体以合适体积进行分装冻存于 -80 ℃ 低温冰箱中,以备后续实验使用。
上下滑动查看更多
注意事项
1、新的 Exosome Extraction Column 柱子的上筛板和填料表面之间可能存在一定的空隙,该现象是运输过程中晃荡造成的,并不影响其性能,实验前将筛板向下推动至填料表面即可;
2、Exosome Extraction Column 和 Exosome Purification Filter 均为一次性耗材,请勿重复利用,否则可能会造成堵柱而损失样品;
3、Solution C 为 Tris 缓冲盐溶液;
4、流穿液呈红色,是由于培养基中色素和外泌体同时被洗脱所致,不影响后续实验。若需去除色素,可使用 100 KD 超滤柱置换缓冲液;
按照以上步骤,通过阴离子交换色谱法原理,填料与被分离样本中带负电荷的外泌体相结合,可以更好适用于细胞培养上清液、尿液等非黏稠性样本中的外泌体提取纯化。宇玫博外泌体提取纯化试剂盒-柱纯化,助你搞定每一次外泌体提纯。
点击下方图片,免费申请试用



产品优势
● 方便快速:提取过程不需要高速离心机,上样到获得外泌体仅需 1 h
● 稳定性高:无剪切力,保留外泌体的完整性和生物活性
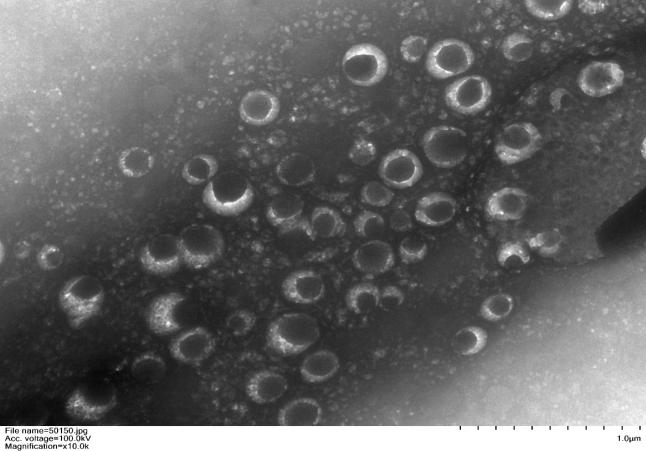
● 纯度高:层析法纯度更高,回收率 30%,粒径均一且重复性好
成功案例
悬浮 293 细胞上清项目

葡萄外泌体项目
工艺流程:榨汁 → 纱布过滤 → 低速离心 → 高速离心 → 调节 pH → 高速离心 → 0.22 μm 滤膜过滤 → 试剂盒提取

牛奶外泌体项目
工艺流程:去脂 → 去蛋白 → 调 PH → 多级澄清过滤 → 试剂盒提取
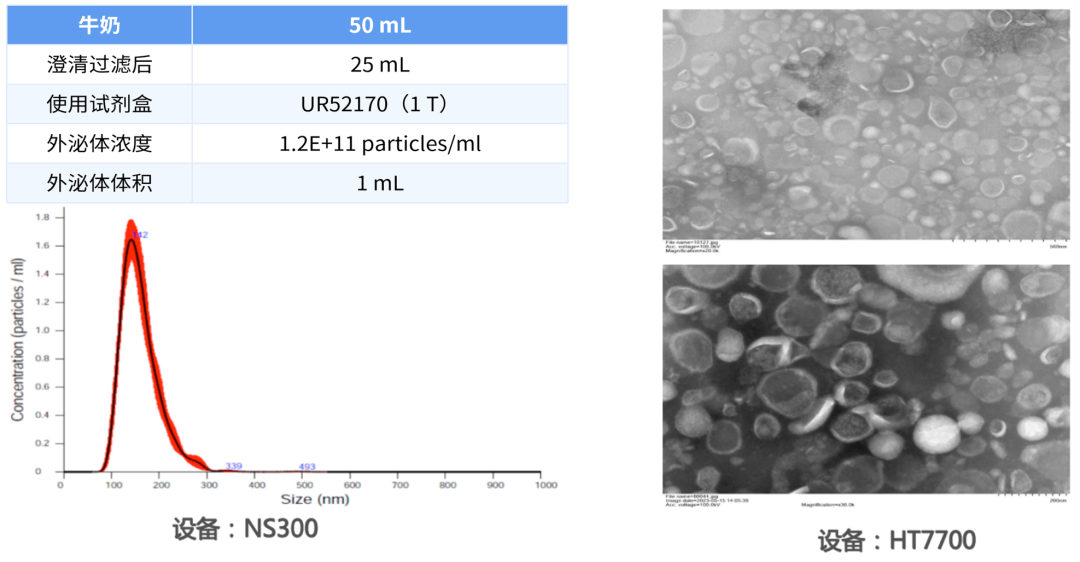
左右滑动,查看更多
如果你也在为外泌体提取纯化而烦恼,赶快点击上方图片申请试用吧!
内容策划:王丹琦
内容审核:吴军
题图来源:图虫创意