又是一年毕业季,师兄师姐们都着急给文章找个期刊。忐忐忑忑一个多月,文章终于有了审稿意见。
好消息:没被拒,需要修;
坏消息:需要修的包括 WB 实验。
看似完美的 WB 条带,哪里出了问题?
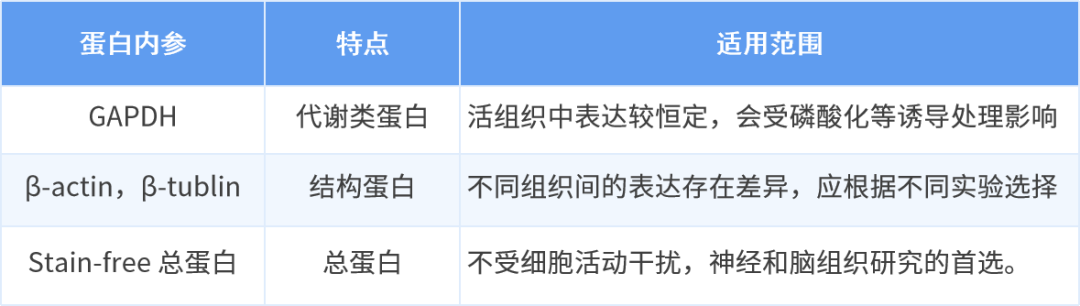
千辛万苦搞定了 WB 条带非特异、背景深、显色过曝……却忽略了内参的问题,甚至差点出现假阳性。除了 β-actin 和 GAPDH,原来在一些实验上(如神经细胞)有更好的内参选择!
在最新发表在神经领域一区 Neurobiology of disease 的创新性研究中,研究者基于行为学分析并结合大量 WB 实验(利用 Stain-Free 免染总蛋白作为 WB 内参),表明 Ts66Yah(唐氏综合征)小鼠模型中,随着年龄的增长,氧化还原平衡、蛋白质平衡、应激反应、代谢通路、程序性细胞死亡和突触可塑性的调控变化,为理解衰老相关的脑疾病提供新的理论基础[1]。
研究方法和思路学起来
1. 首先对 Ts66Yah 小鼠进行行为学分析,表明随着年龄的增长,小鼠认知能力出现障碍并伴随行为异常改变。
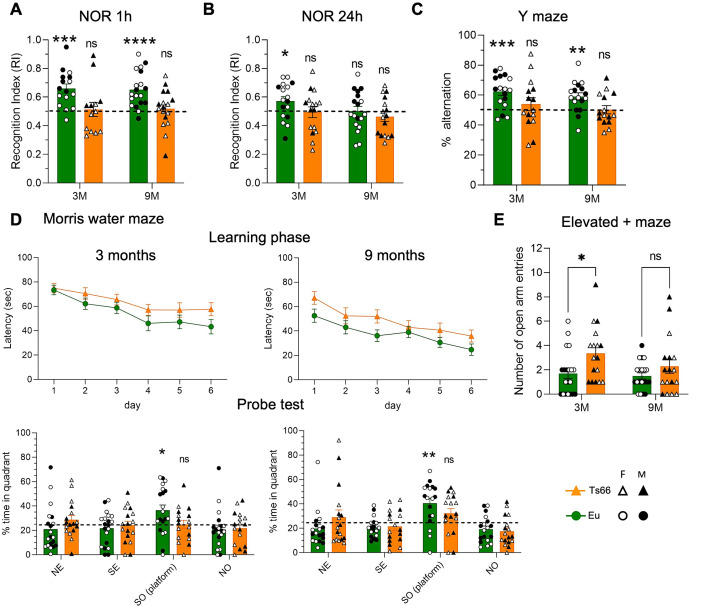
图 1. Ts66Yah 小鼠衰老过程中的认知和行为缺陷
2. 进一步研究者发现 Ts66Yah 小鼠具有明显的神经退行性变的分子特征。
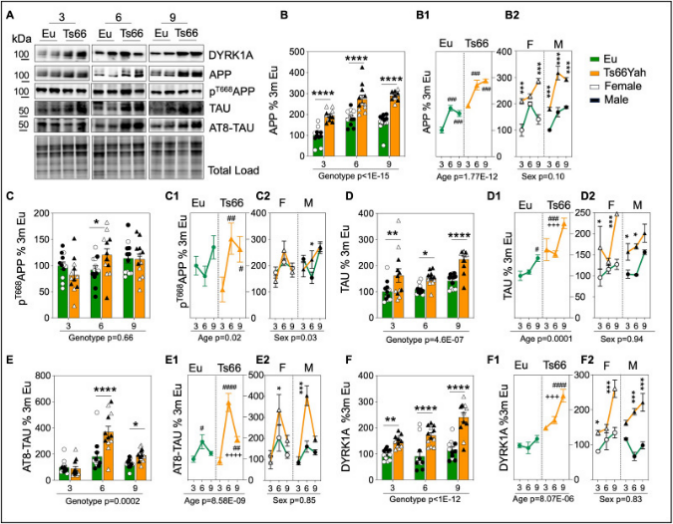
图 2. Ts66Yah 小鼠神经退行相关的分子标志检测
3. 内在分子机制探究,研究结果表明 Ts66Yah 小鼠脑组织中线粒体氧化还原失衡、细胞凋亡增加以及突触可塑性发生异常改变。
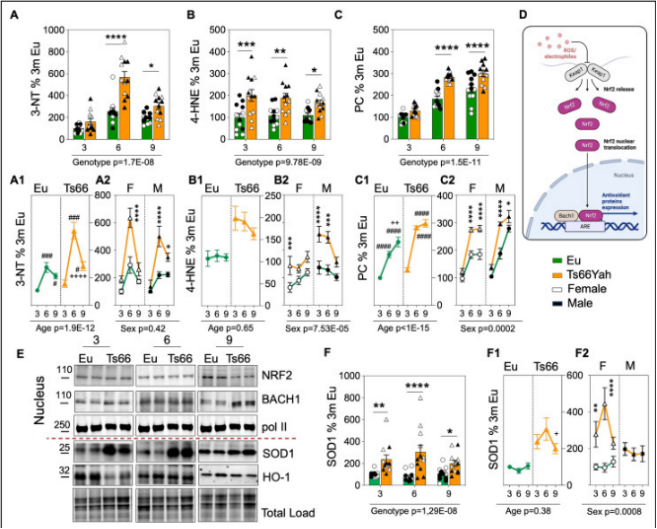
图 3. Ts66Yah 小鼠海马区线粒体失衡
总之,该研究通过行为检测以及 Western Blot、线粒体呼吸检测等探究内在的分子机制,加深了对衰老相关脑组织的分子变化机制的理解。值得一提的是,Stain-free 总蛋白作为内参的 WB 实验,为本研究的机制发现提供重要信息,也为神经研究提供有利、可靠工具。
获得发表级高质量数据的实验技巧
1. Stain-free 总蛋白作为内参的优势及应用
在 WB 实验中,内参的选择尤为重要。越来越多的研究表明,传统的细胞骨架蛋白 β-tubulin 或 β-actin 在神经元细胞分化过程中会发生动态变化[2]。这无疑给蛋白定量分析带来一定干扰,因此需要选择新的总蛋白内参指标。Stain-Free 被证明是一个比常用管家蛋白(actin、tubulin、GAPDH)更为稳定、精准的内参定量参考,并且具有更为理想的线性动态范围,可以作为传统管家蛋白内参的替代[3]。
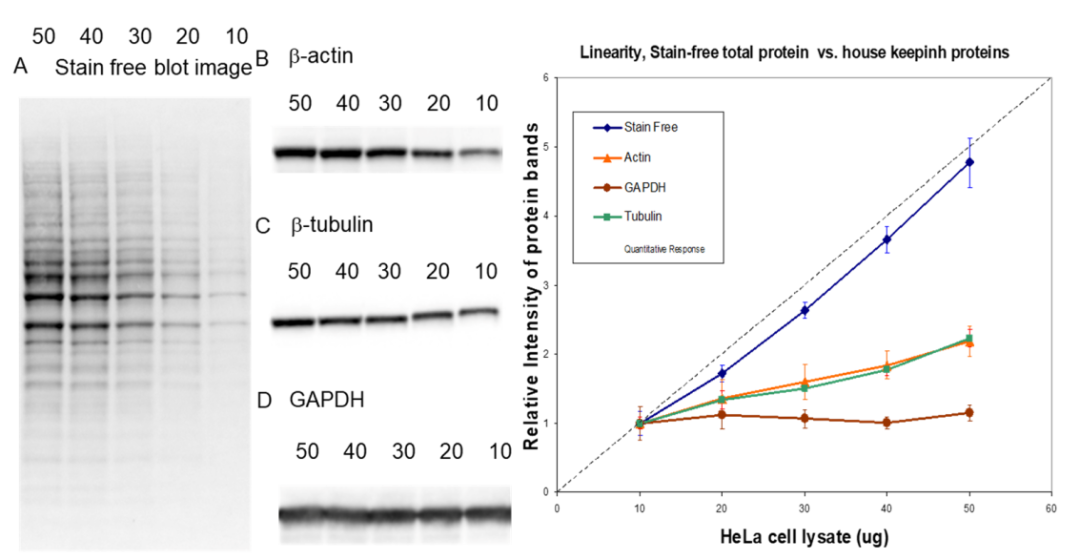
图 4. 相同实验条件下,Stain-Free 总蛋白信号与 actin、tubulin、GAPDH 的动态范围差异
与传统管家蛋白相比,Stain-Free 免染总蛋白在不同神经组织部位(突触小泡、粗突触体、含有突触小泡的 LP1 上清液、突触体膜、可溶性突触体膜、突触后密度)的表达更为恒定,更适合作为神经相关样品 WB 的内参[4]。
2. β-actin,GAPDH,stain-free 总蛋白内参如何选择?
3. WB 实验常见问题及解决方法
1)出现非特异性条带
① 一抗非特异性与蛋白结合。建议更换新的一抗。
② 目标蛋白有多个修饰位点,一抗可与其他位点结合。建议更换别的不同种属或类型的一抗。
③ 蛋白降解,但其抗原表位依旧能够被一抗识别并结合。建议添加蛋白酶抑制剂。
2)背景深
① 封闭问题:封闭物浓度过低;封闭时间过短;封闭物选择不当。选择合适的封闭物及封闭物浓度。常规封闭一般为室温 2 小时,若效果不佳可选择 4℃ 过夜。
② 一抗稀释比例不合适。建议对抗体进行滴度测试,选择最适宜的抗体稀释度。
③ 孵育温度过高。可考虑 4℃ 过夜孵育。
3)显色过曝
WB 显色过曝常常由于曝光时间过长或化学发光底物使用不当。因此应选择低灵敏度的化学发光底物或缩短曝光时间,若条带很弱,逐渐增强曝光强度。

在 WB 实验中,内参的挑选对于确保实验结果的准确性、促进分子机制探索具有不可或缺的重要性。Stain-Free 免染总蛋白技术能够在无需额外标记或抗体的情况下,对凝胶上的总蛋白进行可视化,提供准确且可靠的蛋白质定量数据。不仅简化了实验操作,而且显著提高了实验结果的准确性和可靠性。
如您需要了解更多的 Stain-Free 免染 Western 实验流程或申请试用,请点击下方小程序码,了解更多。

注:
1. 相关产品仅限科研使用,不作为临床诊断。
2. Bio-Rad 是 Bio-Rad Laboratories, Inc. 在特定区域的商标。
内容策划:潘成
内容审核:周育红
题图来源:Bio-Rad
参考文献
[1]. Lanzillotta C, Baniowska MR, Prestia F, et al. Shaping down syndrome brain cognitive and molecular changes due to aging using adult animals from the Ts66Yah murine model. Neurobiol Dis. 2024 May 4;196:106523. doi: 10.1016/j.nbd.2024.106523.
[2]. Hallett PJ, Collins TL, Standaert DG, Dunah AW. Biochemical fractionation of brain tissue for studies of receptor distribution and trafficking. Curr Protoc Neurosci. 2008 Jan;Chapter 1:Unit 1.16. doi: 10.1002/0471142301.ns0116s42.
[3]. Li R, Shen Y. An old method facing a new challenge: re-visiting housekeeping proteins as internal reference control for neuroscience research. Life Sci. 2013 Apr 19;92(13):747-51. doi: 10.1016/j.lfs.2013.02.014.
[4]. Ve H, Cabana VC, Gouspillou G, Lussier MP. Quantitative Immunoblotting Analyses Reveal that the Abundance of Actin, Tubulin, Synaptophysin and EEA1 Proteins is Altered in the Brains of Aged Mice. Neuroscience. 2020 Aug 21;442:100-113. doi: 10.1016/j.neuroscience.2020.06.044.