来源:丁香学术
导读
T 细胞,作为免疫系统中的特种兵,它们识别并消灭感染细胞和肿瘤细胞,保护我们免受疾病的侵害。然而,肿瘤细胞非常狡猾,它们能够开发出多种机制来逃避 T 细胞的攻击,其中一种方式就是通过改变肿瘤微环境的生物力学特性,使得 T 细胞功能耗竭,无法有效地执行其免疫监视的职责。尽管研究者们已经认识到 T 细胞在肿瘤微环境中的功能变化,但是肿瘤细胞如何通过改变其周围环境的物理属性来影响 T 细胞的行为,这一点在以往的研究中并没有得到充分的探讨。
2024 年 5 月 13 日,来自厦门大学的周大旺、陈兰芬和中国人民解放军陆军军医大学(第三军医大学)的叶丽林等研究团队在 Cell 上在线发表题为「Osr2 functions as a biomechanical checkpoint to aggravate CD8+ T cell exhaustion in tumor」的论文,研究团队发现 Osr2 作为一个生物力学检查点,通过加剧 CD8+ T 细胞的耗竭来推动肿瘤微环境中的免疫逃逸。具体来说,Osr2 通过 Piezo1/CaMKII/CREB 信号轴整合生物力学信号,进而招募 HDAC3 来调控表观遗传程序,抑制细胞毒性基因表达,从而促进 CD8+ T 细胞耗竭。此外,Osr2 在肿瘤浸润的 PD-1+TIM-3+晚期 TEX 细胞中富集,并且 Osr2 的缺失能够增强抗肿瘤免疫反应。本研究揭示了肿瘤微环境中的生物力学压力如何通过 Osr2 来影响 T 细胞功能,并为开发新的癌症治疗策略提供了潜在的生物力学分子靶点。

图 1:相关研究(图源:Cell)
主要研究内容
1、机械应力下 CD8+ T 细胞中的 Osr2 被选择性诱导并促进 CD8+ T 细胞的耗竭
研究者观察到在实体肿瘤中,密度高的纤维化基质胶原区域硬度更高,而在人肝细胞癌(HCC)周围的致密纤维化胶原区域中,T 细胞表达 PD-1 和 TIM-3,这两个是晚期耗竭 CD8+ T 细胞(TEX)的标志。而 Piezo1 是一种机械敏感离子通道,在激活的 CD8+ T 细胞中高表达,并且其介导的 Ca2+信号在高硬度聚二甲基硅氧烷(PDMS)凝胶上培养的激活 CD8+ T 细胞中增强。使用 Piezo1 的抑制剂 GsTMx4 可以减少在体外硬基质上培养的 CD8+ T 细胞的耗竭。为了探索其中的机理,研究人员通过 RNA-seq 分析,发现在 Yoda1(Piezo1 的激活剂)处理的活化 CD8+ T 细胞中,Osr2 表达上调,并发现 Osr2 的诱导需要 T 细胞受体(TCR)信号和机械力信号的双重激活。
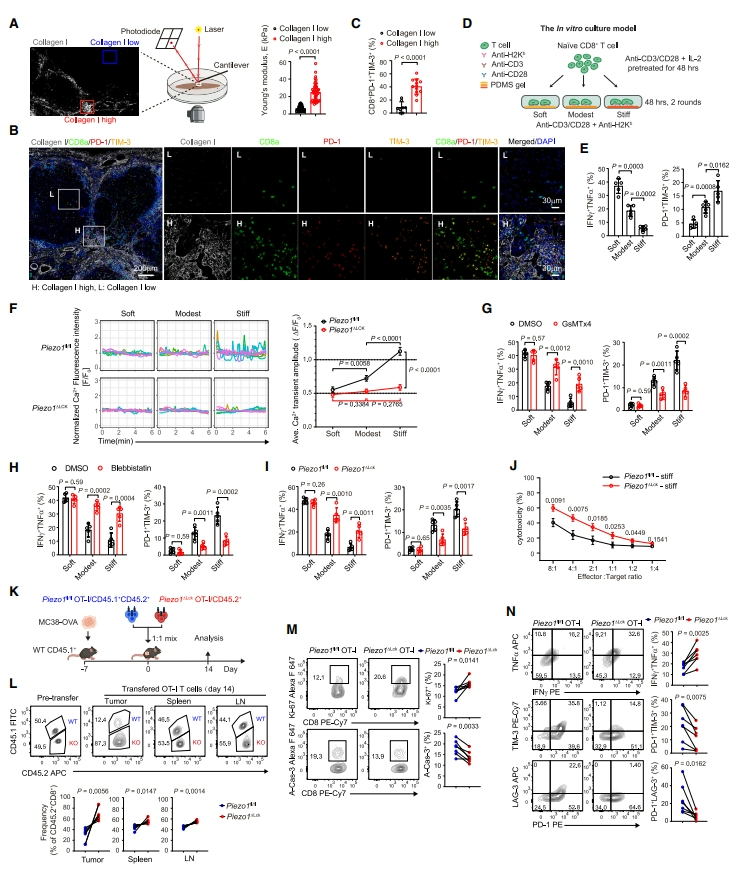
图 2:机械应力会加剧 CD8+ T 细胞的耗竭(图源:Cell)
2、Osr2 整合机械力信号促进 T 细胞耗竭
为了研究 Osr2 是否参与机械力信号介导的 TEX 诱导,研究者生成了特异性敲除 Osr2 的 T 细胞(Osr2△Lck)小鼠,并通过体外实验发现,缺乏 Osr2 的 T 细胞在硬质基质上培养时, PD-1+TIM-3+ TEX 的诱导被显著阻断。在肿瘤中的 Osr2△Lck T 细胞也表现出更高的 IFNγ+ TNFα+细胞比例和更低的 PD-1+LAG-3+或 PD-1+TIM-3+ TEX 比例。进一步通过 scRNA-seq 分析,研究者发现 Osr2 在 MC38-OVA 肿瘤小鼠模型中的肿瘤浸润性淋巴细胞(TILs)中特异性富集,特别是在表达 PD-1+和 TIM-3+的晚期 TEX 亚群中,并且研究者使用 NetBID 算法对公开的 RNA-seq 数据集进行分析,确认了 Osr2 在不同小鼠肿瘤模型中的晚期 TEX 细胞中作为关键转录因子的富集。
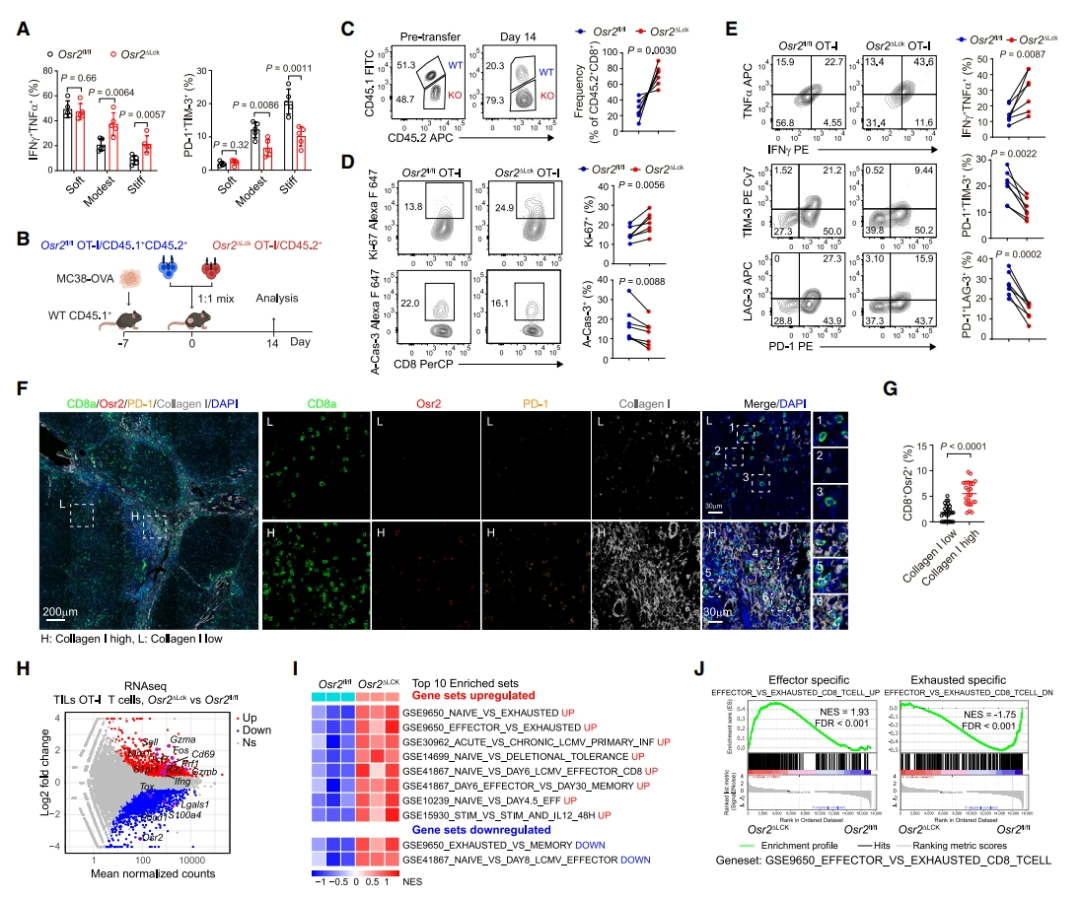
图 3:Osr2 整合机械力信号以促进 T 细胞耗竭(图源:Cell)
3、Osr2-HDAC3 轴对 CD8+ T 细胞耗竭的表观遗传编程
接着,研究者发现 Osr2 过表达的 P14 T 细胞在 LCMV Cl13 病毒感染的小鼠中表现出递减的 T 细胞数量和增强的耗竭标志物表达,这表明 Osr2 的过表达在病毒感染的情况下推动了 Tex 的关键特征。通过共免疫沉淀实验,研究者发现 Osr2 与多种组蛋白去乙酰化酶(HDACs)家族蛋白相互作用,特别是与 HDAC3 的相互作用,能够抑制细胞毒性基因的表达。进一步研究表明,Osr2 和 HDAC3 在细胞毒性基因如 Ifng 和 Prf1 的启动子区域共同富集,并且 Osr2 能够招募 HDAC3 来降低这些区域的 H3K27ac 信号,从而抑制基因表达。使用 HDAC3 的抑制剂 RGFP966 能够部分逆转 Osr2 过表达 T 细胞中 TNFα 和 IFNγ 的降低,这表明 Osr2 通过招募 HDAC3 来抑制 CD8+ T 细胞的细胞毒性程序。
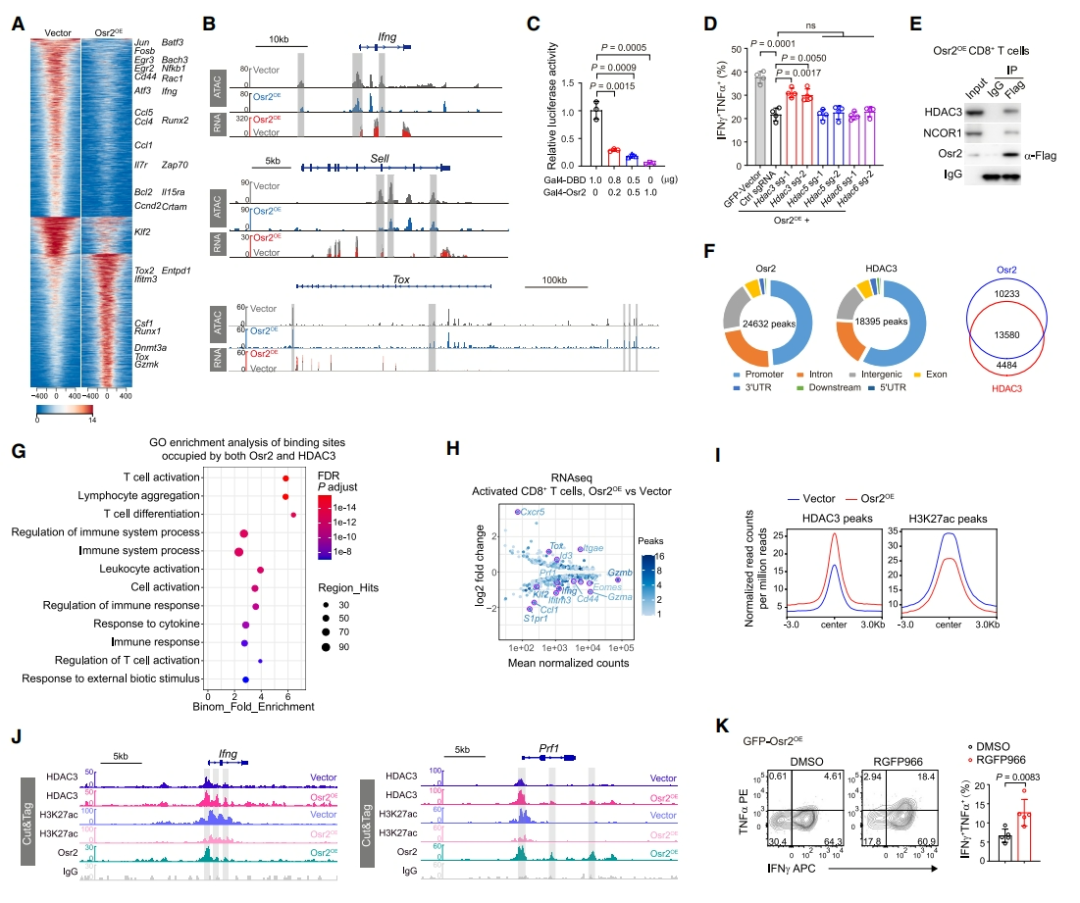
图 4:Osr2 通过招募 HDAC3 来抑制 CD8+ T 细胞的细胞毒性程序(图源:Cell)
4、Osr2 的缺失增强抗瘤免疫
为了确定敲除肿瘤反应性 CD8+ T 细胞中的 Osr2 是否可以增强抗肿瘤能力,研究者通过在不同硬度的肿瘤微环境中移植 B16-OVA 细胞,建立了肿瘤模型,并转移了 Osr2 敲除的 OT-I T 细胞,结果提示 Osr2 敲除的 OT-I T 细胞在肿瘤中的抗肿瘤能力显著增强,特别是在硬质基质的肿瘤微环境中,这些 T 细胞能更有效地控制肿瘤生长。此外,从 Osr2 缺失的 T 细胞生成的 CAR-T 细胞在体内控制 MC38-hCD19 肿瘤的能力显著增强。这些 CAR-T 细胞在肿瘤微环境中的频率更高,表现出更多的增殖标志物 Ki-67+细胞和更少的凋亡细胞。
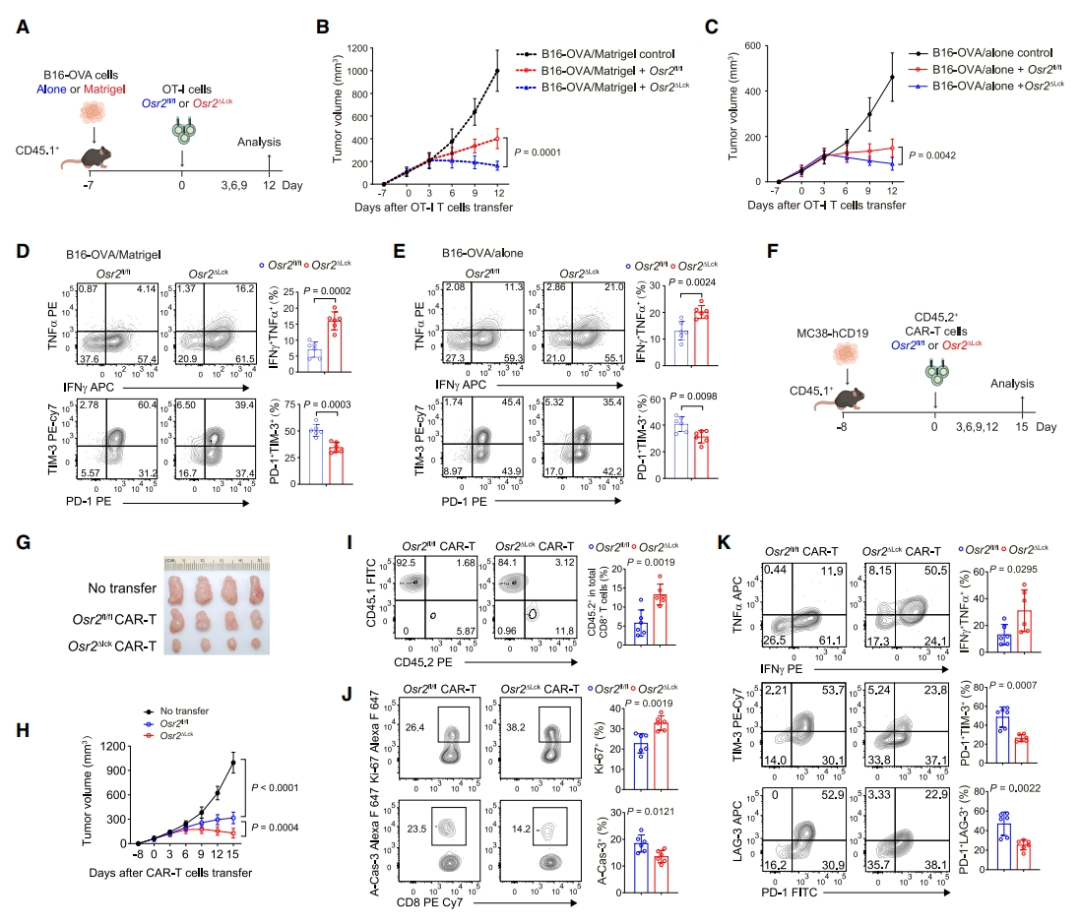
图 5:Osr2 的缺失增强抗肿瘤免疫力(图源:Cell)
总结
本研究主要发现 Osr2 在受到机械应力的活化 CD8+ T 细胞中被选择性诱导,并通过 Piezo1/CaMKII/CREB 信号轴发挥作用。Osr2 的表达增加与 T 细胞耗竭的增强相关联,而 Osr2 的缺失则能够减轻 T 细胞耗竭,提高 T 细胞的抗肿瘤效能。而通过敲除或药物清除 Osr2 能够增强 CD8+ T 细胞的抗肿瘤免疫反应,为癌症免疫治疗提供了新的靶点和治疗策略。
通讯作者资料:
周大旺
厦门大学副校长,教育部***奖励计划特聘教授,国家杰青,博士生导师,长期从事 Hippo 信号通路的生物学功能和调控机制研究,探究其失控导致免疫失调、癌症发生等疾病的致病机理和靶向干预的策略,聚焦损伤组织的修复再生和尺寸大小如何调控的科学问题开展了系列研究。
陈兰芬
博士生导师,闽江学者奖励计划特聘教授、国家优秀青年科学基金获得者、国家杰出青年科学基金获得者、中国青年女科学家奖获得者,现任厦门大学生命科学学院课题组长、厦门大学生命科学学院教授。主要研究 Hippo 信号通路在免疫系统功能调控、细胞分化、衰老及稳态维持等细胞生命活动中的功能及其调控机制。
叶丽林
博士生导师,国家 973 计划首席科学家、入选科技部科技创新中青年领军人才、药明康德生命化学学者奖、中国科协求是杰出青年奖,陆军军医大学全军免疫学研究所教授,主要研究方向为病毒免疫学及肿瘤免疫学,重点研究 T 细胞应答在慢性病毒感染及肿瘤的发生、发展及转移中的关键作用以及改造、修饰及诱导 T 细胞用于慢性病毒感染及肿瘤的免疫治疗。

图片来源:图虫创意
投稿合作:shanglutong@dxy.cn ( 可为课题组代发研究宣传,招聘启事等;同时招聘生物学相关专业兼职作者,有意者可投递简历或相关材料至邮箱)
参考资料:
[1] Zhang JJ et al. Osr2 functions as a biomechanical checkpoint to aggravate CD8+ T cell exhaustion in tumor,cell 2024.