来源:iNature
结核病是一个重大的全球公共卫生威胁。尽管长期使用对氨基水杨酸 (PAS) 作为二线抗结核药物,但其耐药机制尚不清楚。
2024 年 1 月 5 日,复旦大学张文宏及陈嘉臻等团队合作在 mBio 在线发表题为「Mutations in the promoter region of methionine transporter gene metM (Rv3253c) confer para-aminosalicylic acid (PAS) resistance in Mycobacterium tuberculosis」的研究论文,该研究发现甲硫氨酸转运基因 metM (Rv3253c) 启动子区域突变导致结核分枝杆菌对氨基水杨酸 (PAS) 产生耐药性。该研究在 7 H11 固体培养基中分离出 90 株耐 PAS 的结核分枝杆菌 (MTB) H37Ra 突变体,对 MTB 进行全基因组测序、基因过表达、转录水平比较和氨基酸水平测定,并利用 β-半乳糖苷酶检测结核分枝杆菌启动子活性,以阐明 PAS 耐药的机制。作者发现 90 个 PAS 耐药突变体中有 47 个 (52.2%) 在 metM (Rv3253c) 和 Rv3254 的基因间区有 9 个不同的突变。β -半乳糖苷酶测定证实突变只增加了 metM 的启动子活性,而 Rv3254 没有。
有趣的是,在 MTB 中,通过 MetM 的启动子或外源表达 MetM 或其结核分枝杆菌同源物 (MSMEI_1796) 以蛋氨酸依赖的方式过表达诱导 PAS 抗性。因此,当使用缺乏蛋氨酸的标准 7 H10 或 7 H9 培养基时,metM 启动子突变体的药敏结果可能会产生误导。在代谢水平上,PAS 处理导致突变体细胞内蛋氨酸水平高于野生型,从而拮抗 PAS 并赋予抗性。此外,在临床结核分枝杆菌菌株中鉴定出 12 种不同的 metM 启动子突变。总之,该研究发现了 MTB 中 PAS 耐药的新机制。metM (Rv3253c) 启动子的突变上调 metM 转录并提高细胞内蛋氨酸,从而拮抗 PAS。该结果揭示了 MTB 中 PAS 耐药性的机制,并突出了当前 PAS 敏感性培养基的问题。

结核病 (TB) 仍然是对全球公共卫生的巨大威胁,在 2019 年冠状病毒病 (COVID-19) 大流行发生之前,它是单一传染性病原体导致死亡的主要原因,其致死率甚至超过了艾滋病毒/艾滋病。仅在 2020 年,估计就报告了 990 万例新发结核病病例。相当于每 10 万人中 127 例。耐多药结核病 (MDR-TB) 或利福平耐药结核病的患病率在新诊断患者中约为 3%-4%,在有治疗史的患者中约为 18%-21%。1946 年最初用于结核病治疗的对氨基水杨酸 (PAS) 已成为二线抗结核药物。鉴于耐多药结核病的增加,在强化治疗阶段,PAS 经常作为 C 组药物纳入耐多药结核病方案。虽然 PAS 与链霉素联合应用以减少耐药结核病的出现可以追溯到 1952 年,但耐药的确切机制仍然难以捉摸。作为一种通过叶酸合成途径激活的前药,PAS 可以生物转化为叶酸中间类似物羟基-H2Pte 和羟基-H2Pteglu,从而破坏结核分枝杆菌 (MTB) 的叶酸代谢。
已知的 PAS 抗性相关基因,包括 thyA、dfrA、folC 和 ribD,编码 MTB 中负责叶酸生物合成的酶。在来自中国的临床分离株中,在 PAS 耐药的临床分离株中最常遇到和发现 folC 突变。对 MTB H37Rv、H37Ra 和牛分枝杆菌 Calmette- Gusamrin (BCG) 的自发 PAS 抗性突变株的研究已经确定了 folC 突变是 PAS 抗性的来源。相比之下,thyA、dfrA 和 ribD 的突变最初是通过牛分枝杆菌 BCG 的转座突变文库发现的。首先在 PAS 耐药的牛分枝杆菌卡介苗转座突变体中发现,随后在临床分离株中发现,其 PAS 耐药性高达 100 倍。dfrA 或 ribD 的过表达也导致 MTB 中 PAS 的耐药。在高表达水平下,RibD 可以作为 PAS 靶标的替代二氢叶酸还原酶 (DHFR) 发挥作用,补偿 MTB 中编码 DHFR 的 dfrA 的遗传缺失。在 MTB 分离物中,ribD 上游 11bp 处的一个自发突变增加了 ribD 的表达,导致 PAS 抗性。
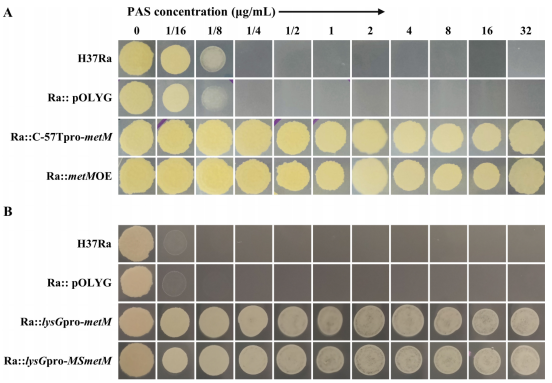
metM过表达菌株的PAS敏感性试验(图源自mBio )
上述基因突变的临床 PAS 耐药菌株的发生率为 61.1% ~ 91.8%。虽然这些结果并不完全一致,但它们共同表明,已知的耐药突变不能解释所有 PAS 耐药病例。先前的研究试图通过在含有 PAS 的培养基中体外筛选 MTB 突变体来阐明其他未知的耐药机制。对 folC 突变株和非 folC PAS 抗性菌株的多组学比较显示,非 folC 突变株对外源蛋氨酸的吸收增加,减轻了抑制剂的影响,增强了 DfrA 和 ThyA 的表达。
该研究确定了 MTB 中新的 PAS 耐药机制,涉及 metM 启动子区域的突变,该突变导致 metM 转录增加,细胞内蛋氨酸运输和积累增加,最终导致 PAS 耐药。该发现为 MTB 中 PAS 耐药的机制提供了新的见解,有助于改进 PAS 耐药菌株的检测和改进治疗策略。
原文链接:
https://journals.asm.org/doi/10.1128/mbio.02073-23