上周组会,做了两个月 CoIP 的师弟居然没 data!不是 Input 泳道丢了,就是 IP 组没了目的条带?导师一脸黑线,准备亲自下海教学。

基础原理我真的明白!IP 可以实现目的蛋白的纯化和富集;CoIP 则可以进一步研究蛋白之间的相互作用机制。可是一设置实验组我就开始懵。
为证明实验结果的真实性和可靠性,在 CoIP-WB实验中一般需设置以下5 个实验对照组。

Input:阳性对照组,组织细胞裂解液,在做 IP 实验之前,需要先跑 WB,确认样本中含有蛋白 A 和蛋白 B;
IgG:阴性对照组,Anti-X 的同型对照抗体,如 Anti-X 是兔 IgG 型,则同型对照抗体需要选择 Rabbit IgG ;
IP:实验组,免疫沉淀(immunoprecipitation),富集目的蛋白;
Anti-X:X 蛋白的免疫共沉淀抗体;
IB:免疫印迹(immunoblotting),用于显示目的蛋白。
实验 protocol 和常见 QA 我硬盘里应该存了一份,发你看看。

导师亲传
CoIP 实验 Protocol
IP 和 CoIP 实验的流程大致相同,主要包括样品的准备、免疫沉淀、洗涤、洗脱和下游分析。具体步骤如下:
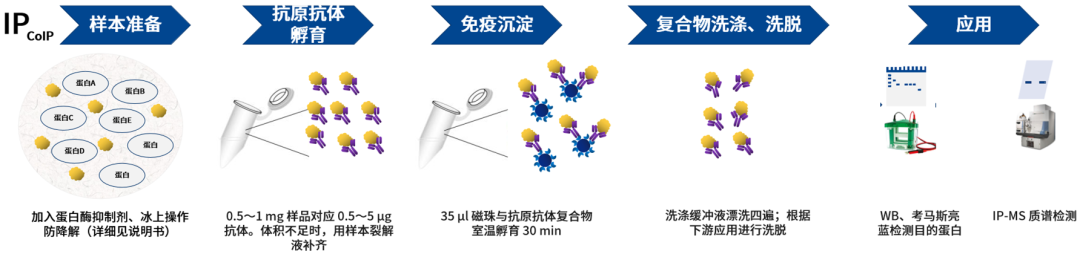
目前 IP 沉淀方式主要有三种:

在 IP/CoIP 实验中常见的两种 Beads 分别为琼脂糖珠和磁珠:

常见 QA 合集
实验难题一次解决
▼上下滑动查看▼
1.
蛋白大小与轻重链相近或相同,无法区分?
点击视频 1 分钟了解构象二抗作用机理与优势
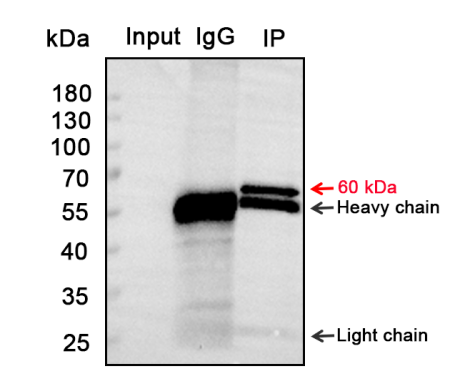
原因:IP 变性洗脱时,抗体在高温和还原剂的作用下,会变性形成轻链和重链。
改进:换用 IP/CoIP 专用的构象二抗(仅识别目的蛋白,不识别轻重链)如 Vazyme #RA1008 和 RA1009;在 IP 和 WB 时,使用不同种属的一抗(需要购买两种抗体);WB 用直标一抗(无二抗信号放大,可能产生信号弱或曝不出的情况)。
2.
Input 泳道无目的条带,IP 组有目的条带?
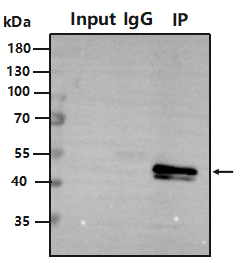
原因:目的蛋白丰度不够或降解,Input 组检测不到,IP 组富集能检测到;
改进:可以做常规 WB 验证,样本处理时添加蛋白酶抑制剂,提高 Input 组上样量。
3.
Input 泳道有目的条带,IP 无信号或目的条带弱?
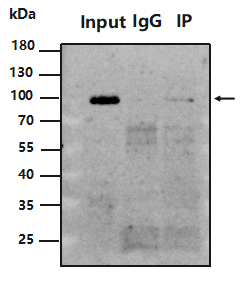
原因:样本抗原量少,不足以被检测到;抗体无法结合抗原;抗体亲和力差;IP 抗体未与磁珠结合。
改进:用 IP 级别的抗体,一般而言,相比于 WB,IP 实验需要更高亲和力的抗体;抗体浓度太低,目的蛋白富集少,无法检测到,选用浓度较高的抗体或增加抗体使用量;增加抗体与磁珠孵育时间;正确保存防止磁珠变质或干燥。
4.
Input 泳道无目的条带,IP 无信号?
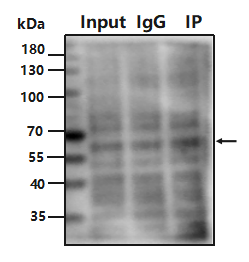
原因:样本降解;样本蛋白丰度低
改进:冰上操作,裂解样本时,加入蛋白酶抑制剂;样本蛋白丰度低,检测不到;提高样本量。
5.
IP 背景高或者出现非特异性信号?
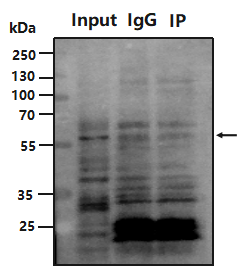
原因:Beads 非特异性结合;非特异性蛋白与 Beads 结合导致背景高;抗体浓度过高或特异性不好;样本降解;
改进:ProteinA/G 与 Beads 结合导致背景高;使用前使用 1~5% 的 BSA 进行预封闭、免疫沉淀后增加漂洗次数和盐离子浓度;或选用特异性更好、效价更高的 Beads,如 Vazyme#PB101(ChIP 级磁珠);选用合适抗体类型和使用浓度;裂解样本时加入蛋白酶抑制剂或新鲜制备样本;投入合适的样本量,样本过多可导致背景高。
6.
相互作用蛋白信号弱?
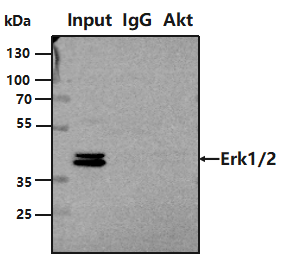
原因:表达量过低;目的蛋白识别表位被互作蛋白所遮盖;在洗涤过程中丢失。
改进:做 WB 先验证蛋白表达量,提高上样量或使用互作蛋白含量高的样本进行实验;选择高亲和力的抗体(IP 级别抗体);实验开始前确定合适的去垢剂和盐离子浓度,防止在洗涤中丢失。
要想实验不白做,选好工具是关键!
好用的磁珠在哪里?
点击下方图片,了解产品详情
👇👇👇
内容策划:王丹琦
内容审核:吴军
题图及文中图片来源:诺唯赞