Western blot 实验作为验证蛋白表达水平的金标准之一,内参的选择必须令人信服,不然实验结果不靠谱不说,还容易误闯科研造假重灾区。一个合格的内参蛋白应当不受疾病病理生理学、性别或药物治疗等变量的影响,并且必须与组织中总蛋白保持恒定的比例。然而,对于神经和脑组织研究,面对以下问题多数人犯难了:
● 如何针对不同样品类型选择内参?
● β-Actin 与 GAPDH 等常用内参有无失效的情况?
● 神经组织和脑组织的内参选择有什么要注意的地方?
如果你也有这些问题,就让我们一起来看看文献里都是怎么解答的吧。
管家蛋白作为 WB 内参在神经元分化过程中有何局限性?
NTera-2/clone D1(NT2)和 SH-SY5Y 是神经元分化研究中最常用的两种细胞系。NT2 细胞被用作研究人胚胎干(hES)细胞多巴胺能分化的模型系统。SH-SY5Y 细胞系广泛用作神经元分化、存活和凋亡的细胞培养模型。
管家蛋白在以这两种细胞系为研究材料的 Western 实验中是非常用的。但是,越来越多的证据表明,这些管家蛋白本身会受到药物治疗、细胞周期阶段、分化或细胞增殖的影响。神经元分化是一个动态过程,涉及细胞蛋白表达的显着变化。研究表明(视黄酸,RA)诱导的 NT2 和 SH-SY5Y 细胞分化期间 β-actin、β-tubulin 的表达具有显著差异[1]。如果不加验证,以 β-actin、β-tubulin 为内参,就有可能会造成误导性的 Western 定量结果。
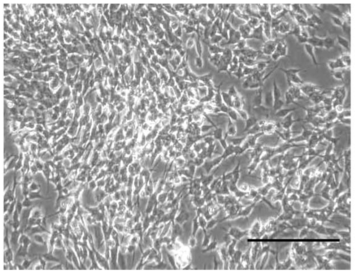
未分化的神经元细胞
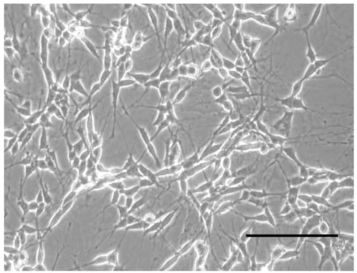
已分化的神经元细胞
图 1 未分化和已分化的 SH-SY5Y 细胞
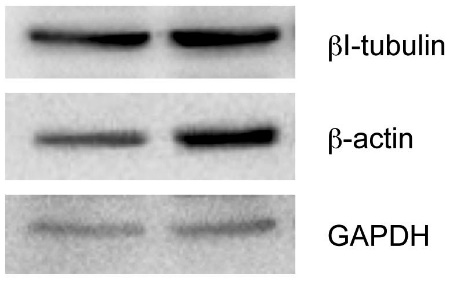
未分化 已分化
图 2 常用的三种管家蛋白 β-tubulin、β-actin 及 GAPDH 在未分化及已分化 SH-SY5Y 细胞系中的 Western 条带
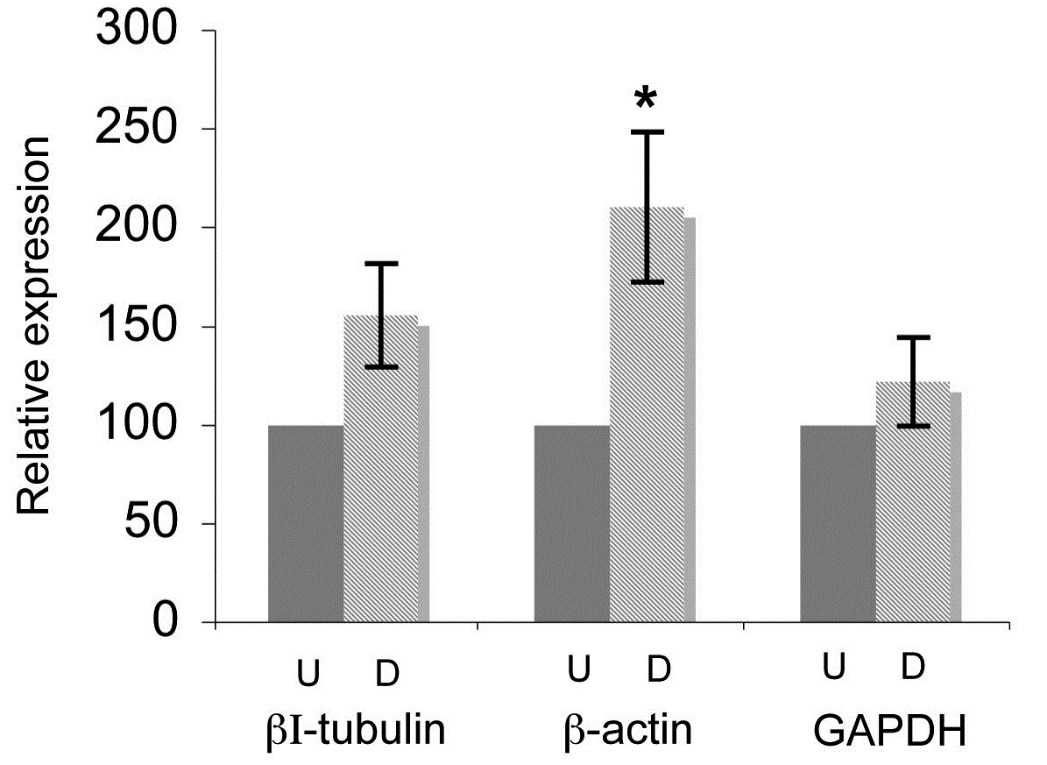
图 3 β-tubulin、β-actin 及 GAPDH 在未分化及已分化 SH-SY5Y 细胞系中的表达差异
从研究结果来看,actin 在未分化及已分化 SH-SY5Y 细胞系样品中的表达量差异竟有 2 倍之多;tubulin 的表达量差异也在 1.5 倍左右;GAPDH 的表达略为稳定,但也出现了较为明显的差异化。
Stain-Free 被证明是一个比常用管家蛋白(actin、tubulin、GAPDH)更为稳定、精准的内参定量参考,并且具有更为理想的线性动态范围,是传统管家蛋白内参的替代[2]。
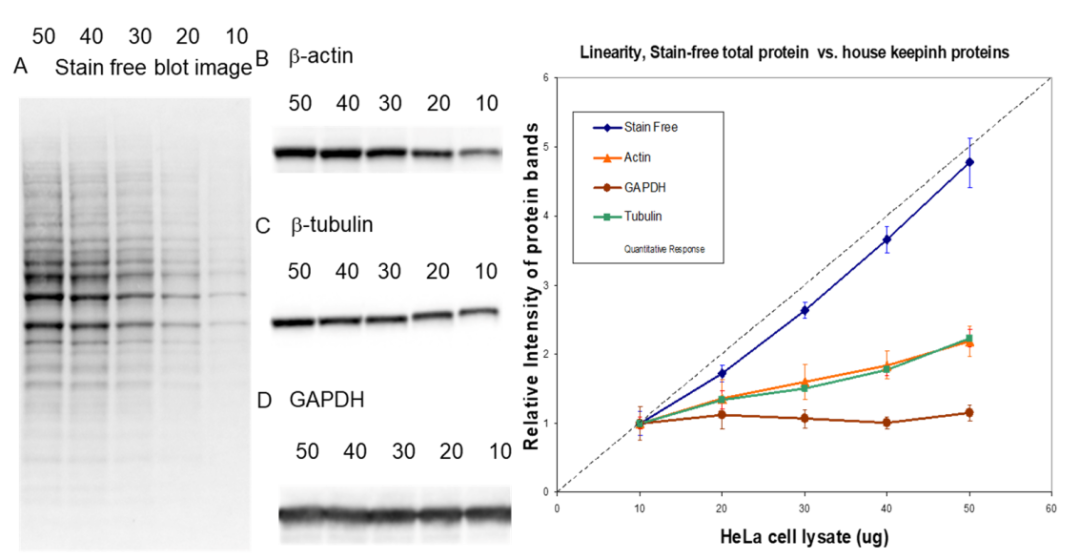
图 4 相同实验条件下,Stain-Free 总蛋白信号与 actin、tubulin、GAPDH 的动态范围差异
β-tubulin 与 β-actin 作为神经样品 Western 的内参靠谱吗?
既然管家蛋白表达水平在神经相关组织中是容易发生变化的,例如作为细胞骨架的 β-tubulin 或 β-actin 在神经元细胞分化过程中就会发生变化[3]。因此,在使用前需要进行严格的验证。
为确认什么样的内参更适合以神经细胞或组织作为样品的 Western 内参,魁北克大学 Lussier 实验室详细研究了小鼠不同脑组织部位的管家蛋白表达情况。特别比较了年龄为 7 个月(对照)和 22 个月(老年)小鼠的蛋白脑组织部位的表达情况[4]。研究者发现,在多个亚组织部位(如粗突触体、含有突触小泡的 LP1 上清液、突触后密度),β-tubulin 与 β-actin 都发生了明显变化。这种情况下,如果继续使用 β-tubulin 与 β-actin 作为 Western Blot 实验内参,则会带来误导性的定量结果。

图 5 小鼠不同脑组织中 β-tubulin 与 β-actin 表达都发生了明显变化(P2:粗突触体;LP1:突触体膜;PSD:突触后密度)
这样的结果并不出人意外,作为细胞骨架的 β-tubulin 与 β-actin 是树突组织的主要成分,对于维持树突棘形态、组织 PSD 及锚定/稳定突触后体至关重要。而正常衰老会差异性的改变构成神经元结构元素的动态分子实体,如 β-tubulin 与 β-actin 的表达。
β-actin 作为大脑皮层样品内参蛋白表现如何?
大量精神疾病相关中枢神经系统的 mRNA 表达差异已经证实了 β-actin 与 GAPDH 广泛存在的表达不恒定。为证实 β-actin 在中枢神经系统中能否显示出内参蛋白应具有的特征,澳大利亚的神经学研究小组系统性检测了 194 名患有或未患有精神疾病的受试者在布罗德曼区 9(Brodmann’s area 9,BA9)9 中常用内参蛋白 β-actin 的水平[5]。
选择 BA 9 进行这项研究是因为它是背外侧前额叶皮层内的一个区域,该区域被认为受精神分裂症 和情绪障等疾病的病理生理学影响。对于这类样品的测似,有助于了解常用管家蛋白是否会随病理生理学而发生变化。
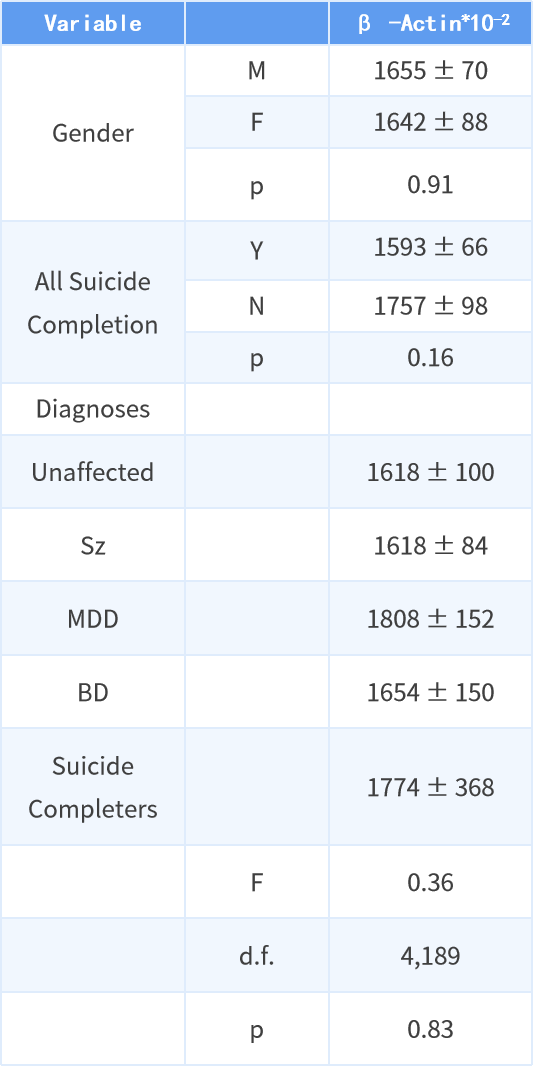
实验测试了 194 名受试者(包括 136 名男性和 58 名女性)的 BA 9 匀浆中 β-acin 的水平。这些受试者的平均年龄为 49 岁,平均脑重量为 1,377 克,平均死后间隔时间(PMI)为 42 小时,平均中枢神经系统 pH 值为 6.32。其中包含 70 名没有精神或神经障碍病史的受试者、75 名精神分裂症受试者、24 名重度抑郁症受试者、17 名双相情感障碍受试者和 8 名没有可识别精神病的自杀者。
跨病例样本的 β-actin 信号总强度范围为 212 至 4,461,变异系数为 47%。β-actin 的总强度在性别、自杀者或其他诊断方面没有显着差异。β-actin 的信号强度与年龄、中枢神经 pH、PMI、中枢神经重量、病期(DI)没有显著相关性。
表 1 β-actin 的信号强度
研究还发现 β-actin 在人中枢神经系统中与组织总蛋白比例也不恒定,这与使用人源细胞系 MDA-MB-231 作为样品的 Western 数据相似:β-actin 水平并未反映起始总蛋白浓度[6]。此外,小鼠中的数据显示 β-acin 水平因组织而异[7]。这些数据都表明,β-actin 和其他看家蛋白(如 GAPDH)可能不应用作内参蛋白,除非它们在待研究的组织或细胞中显示出具有应有的特征(表达量恒定、不受疾病病理生理学或治疗影响、与总蛋白成恒定比例关系)。
与常用的管家蛋白相比,Stain-Free 免染总蛋白在不同神经组织部位(突触小泡、粗突触体、含有突触小泡的 LP1 上清液、突触体膜、可溶性突触体膜、突触后密度)的表达更为恒定,更适合作为神经相关样品 WB 的内参[4]。研究比较了7 个月(对照)和 22 个月(老年)小鼠组织,细胞骨架蛋白的分析表明,老年小鼠的 actin 和 tubulin 水平发生了变化,生理衰老深刻影响与神经递质释放和囊泡循环相关的分子的丰度,这些分子与认知功能有关。与 Actin、tubulin 相比,Stain-Free 的表达在对照与老年小鼠间的表达一致性更高。
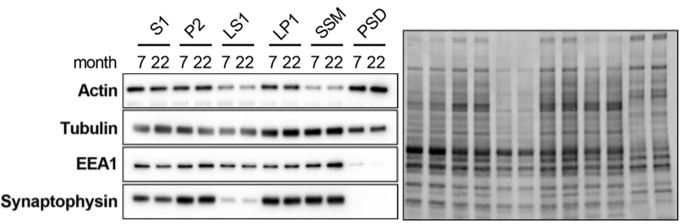
图 6 Stain-Free 与 Actin、tubulin 的表达情况对比(S1:突触小泡;P2:粗突触体;LS1:含有突触小泡的 LP1 上清液;LP1:突触体膜;SSM:可溶性突触体膜;PSD:突触后密度)
自闭症小鼠脑组织样品 WB 内参如何选择
以上说到,在神经元细胞分化过程中,常用的管家蛋白(如 β-actin、β-tubulin、GAPDH)表达量通常会发生变化;在小鼠的不同脑组织部位,这些管家蛋白的表达也常常不一致。所以,在使用这些样品作为 Western 实验材料时,需要特别小心,以免因其表达量的不稳定导致误导性的 Western blot 定量结果。
在一篇《Nature》中[8],为准确使用 Western 定量磷酸化 eIF4E 及磷酸化 MNK1 在脑组织中的表达,采用了 Stain-Free 总蛋白作为内参,而避免使用管家蛋白 GAPDH。在论文中,作者使用小鼠脑组织及皮层神经元匀浆作为 Western 样品。
Western blot 实验用来确定敲除 NIgn3 基因后小鼠脑组织中,磷酸化 eIF4E 及磷酸化 MNK1 水平的变化。研究者发现 GAPDH 的表达差异很大(红框),不适合作为内参使用;而 Stain-Free 总蛋白(绿框)显示出了极佳的表达一致性,从而被研究者选择为内参定量标准。
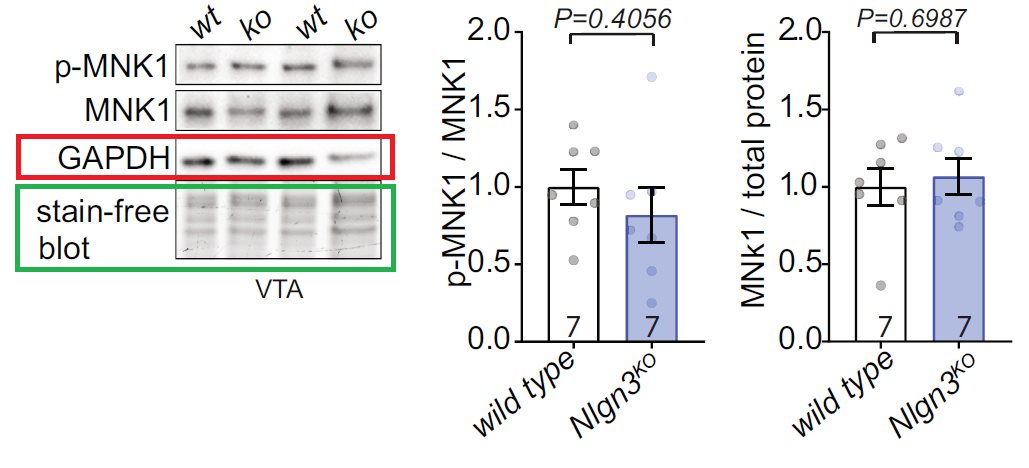
图 7 敲除 NIgn3 基因的小鼠脑组织中磷酸化 eIF4E 及磷酸化 MNK1 水平的变化
从 Western 的定量结果来看,敲除 NIgn3 基因后,MNK1 磷酸化水平没有发生明显变化。而且总 MNK1 的表达与野生型相比也没有明显变化。
从实验 Western 结果来看,在此实验条件下,小鼠脑组织及皮层神经元中 GAPDH 的变化非常大。GAPDH 的表达量变化不仅发生在野生型和基因敲除小鼠之间,甚至在同样的基因敲除小鼠之间,GAPDH 的表达量也是有非常大的差异的。如果没有 Stain-Free 作为参考,贸然以 GAPDH 作为 loading control,实验者必然会根据 GAPDH 条带的差异重新调整上样量,必然得出不正确的 Western 定量结果。
很显然,在这个 western 实验中,Stain-Free 体现出非常明显的表达恒定优势,提供了准确的 western 定量结果。而以 GAPDH 为内参则容易导致错误的定量结论。
今天关于神经和脑组织 western 检测蛋白表达水平的内参选择及注意事项就分享到这,如果需要了解更多 Stain-Free 技术及相关产品,可识别二维码了解更多~

Stain-Free 免染 Western 实验流程

ChemiDoc MP System 全能型成像系统
注:
1. 相关产品仅限科研使用,不作为临床诊断。
2. Bio-Rad 是 Bio-Rad Laboratories, Inc. 在特定区域的商标
内容策划:邹礼平
内容审核:周育红
题图来源:图虫创意
参考文献
[1] Castao, Zafira , and R. M. Kypta . "Housekeeping Proteins: Limitations as References During Neuronal Differentiation." The Open Neuroscience Journal 2.1(2008):36-40.
[2]Li, R. , and Y. Shen . "An old method facing a new challenge: Re-visiting housekeeping proteins as internal reference control for neuroscience research." Life Sciences 92.13(2013):747-751.
[3] Hallett, P. J. , et al. "Biochemical Fractionation of Brain Tissue for Studies of Receptor Distribution and Trafficking." Current Protocols in Neuroscience 42.1(2008).
[4]Ve, Hou , et al. "Quantitative Immunoblotting Analyses Reveal that the Abundance of Actin, Tubulin, Synaptophysin and EEA1 Proteins is Altered in the Brains of Aged Mice." Neuroscience 442(2020).
[5]Parkin, G. M. , et al. "Β‐actin does not show the characteristics of a reference protein in human cortex." Electrophoresis (2019).
[6] Dittmer, Angela , and Jürgen Dittmer. "Beta-actin is not a reliable loading control in Western blot analysis. " Electrophoresis 27.14(2010):2844-2845.
[7] Eaton, S. L. , et al. "Total Protein Analysis as a Reliable Loading Control for Quantitative Fluorescent Western Blotting." PLoS ONE 8.8(2013):e72457.
[8] Hrnberg, Hanna , et al. "Rescue of oxytocin response and social behaviour in a mouse model of autism." Nature 584.7820(2020):1-5.