师弟
上午 10:00

求救师姐!我跑 WB 每次蛋白表达趋势咋都跟理论不符呢?
选的哪个内参蛋白呀?


组织缺氧,选的 GAPDH 做内参,按理目的蛋白表达应该上调,这数据处理完表达没啥差异。
听说缺氧会导致 GAPDH 表达增高,不适合做内参,你换个内参试试呢?


选内参蛋白还有这么多说法呢,白做这么多次了,好费时间啊
内参选不好,对实验结果大有影响的,要提前做好功课才行哦

我们 WB 蛋白表达结果真的可靠吗?明明大量文献已经报道了目标蛋白的表达情况,但在同样的条件下就是无法重复。一次常规的 WB 从配胶到显影至少需要大半天,结果一次次失败,对自己的科研能力逐渐失去信心。
有没有一种可能,是因为内参不合适……
Western Blot 实验中,内参的选择对蛋白定量结果可能产生不同影响(特别是实验重复量不够的情况下,文献1)。下面我们来看一个典型案例:
在通常情况下 E3 连接酶会对 FoxP1 产生降解作用,因此在敲低E3连接酶后,FoxP1 的表达上调。那么在 WB 实验中选择不同的内参,我们会得到怎样的结果呢?
通过转染 dsiRNA 敲低 E3 连接酶后,检测 FoxP1 蛋白表达量表达变化。
➣ 选择 Actin 为内参蛋白时,定量结果显示 FoxP1 没有明显表达差异;
➣ 选择 β-tubulin 为内参时,定量结果显示 FoxP1 有所上调(p = 0.005);
➣ 而选择 Stain-Free 总蛋白为内参时,我们可以得出非常明确的结论:FoxP1 表达量明显上调(P < 0.000 01),符合理论预期!
这个实验案例中,不同的内参竟然会导致 WB 定量结果的差异:
● Actin 内参没有得到统计学意义的结论;
● β-tubulin 内参虽有统计学上的差异,但是结果的差异系数略高;
● Stain-Free 内参不但显示了非常强的统计学差异,并且其差异系数值很低,与理论预期完全一致。
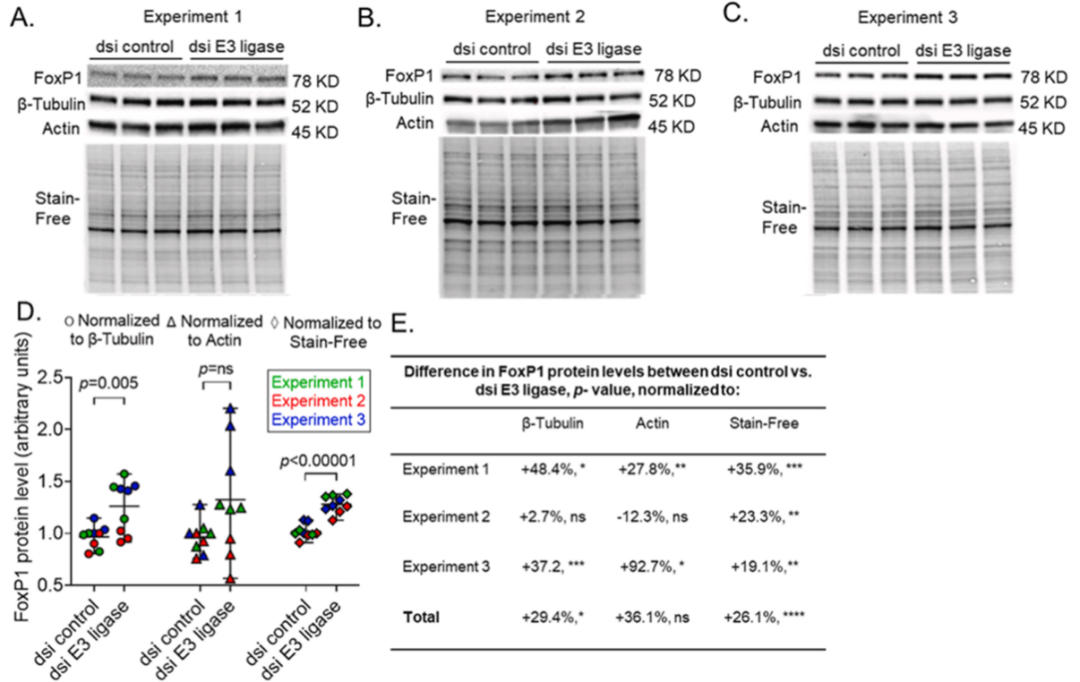
图 1. 与 Actin 或 β-Tublin 归一化相比,用 Stain-Free 信号进行归一化可提高 WB 数据的重现性。(A-C)分别用 dsiRNA 对照和 dsi E3 连接酶转染 BEAS-2B 细胞。裂解产物(20 μg)用 10% 的 Stain-Free 凝胶电泳,转移到 PVDF 膜上。捕获一个无染色图像,膜在 65KD 和 50KD 水平切割,并分别对 FoxP1, β-微管蛋白和肌动蛋白进行免疫印迹。实验重复 3 次,间隔 2 周。(D)分别用 β-Tublin、Actin 或 Stain-Free 信号进行归一化时 FoxP1 蛋白水平的标准差。
原来困扰很多人的 WB 定量不准的问题出在内参的选择上!神奇的 Stain-Free 技术可以实现比普通管家蛋白更精准的 WB 定量!那么,什么是 Stain-Free 技术呢?
Bio-Rad 的 Stain-Free 免染 Western 流程提供了实用、方便且可靠的方法来实现总蛋白内参归一化。在凝胶电泳结束后,仅需 1 分钟激发,就可在凝胶中观察到 Stain-Free 标记的总蛋白信号,并通过成像系统记录总蛋白信号。该技术使研究人员可以轻松地对蛋白质印迹进行总蛋白上样控制。在 Western 实验结束后,目标蛋白条带也被成像系统记录,软件可自动执行总蛋白的内参归一化定量计算,最终确认各泳道对应目标蛋白的真实表达差异。
图源:Bio-Rad
Stain-Free 优于传统的 WB 实验流程,因为它允许使用者:
电泳几分钟后可视化凝胶蛋白条带,而常规电泳分离需要至少 60 分钟;
最快 3 分钟实现快速、高效、均匀的蛋白质转印;
在每个实验步骤执行质量评估,无需染色和脱色;
通过总蛋白归一化提高准确性并产生可靠的定量结果。
Stain-Free 免染 Western 实验流程 :

图源:Bio-Rad
了解更多 Stain-Free Western 实验流程,或者您需要使用或现场介绍 Stain-Free,可识别下方二维码或点击阅读原文申请试用。

注:
1. 相关产品仅限科研使用,不作为临床诊断。
2. Bio-Rad 是 Bio-Rad Laboratories, Inc. 在特定区域的商标。
内容策划:王丹琦
内容审核:周育红
题图来源:Bio-Rad
参考文献
Stain-Free total-protein normalization enhances the reproducibility of Western blot data, Analytical Biochemistry (2022)
点击阅读原文申请试用。
