
师弟

师姐,你的 qPCR 结果我重复不出来 ,结果误差太大,到底哪有问题呀?仪器工程师刚调试过,可以排除。
,结果误差太大,到底哪有问题呀?仪器工程师刚调试过,可以排除。
不会是因为基因丰度或模板量低,这批样品我自己之前包括昨天做了都没有问题,你操作过程有污染的可能吗 ?
?


师姐

师弟

我都是在超净台里面操作的,而且我特意检查了有没有残留的抑制物,用 Nanodrop 测了 OD260/280 没有问题。
那你配体系的时候那 1 μl 的 cDNA 咋加的?


师姐

师弟

就.....往里加呗,这还有讲究 ?
?
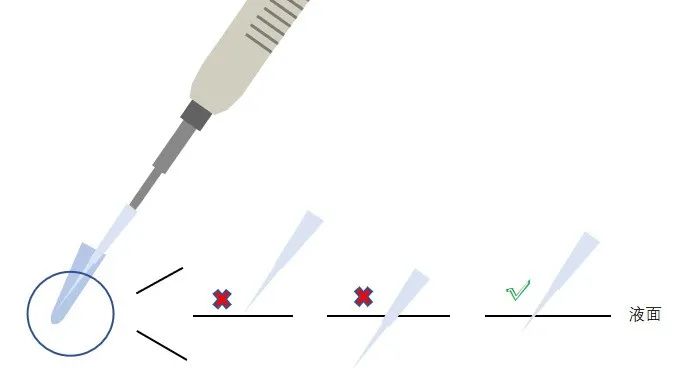
你别不重视 ,1 μl 的体积很小,稍微差一点都有可能影响结果。加样的时候枪头可以伸到液面下一些,也不要没入液面太深,不然液滴有残留实验结果肯定不准。
,1 μl 的体积很小,稍微差一点都有可能影响结果。加样的时候枪头可以伸到液面下一些,也不要没入液面太深,不然液滴有残留实验结果肯定不准。


师姐

师弟

啊?之前真的没想到,我去试试看!
在师姐的指导下,我重做了实验,格外注意了加样的操作,结果真的拿到了满意的曲线图!这周组会终于有数据可以汇报啦 !
!
大家总说 qPCR 实验是一门玄学,经常埋头苦干一整天,结果就是不理想,其实不然,很多时候是仅仅是一些很小的细节没有注意到,就会整盘皆输。那么如何才能游刃有余地进行 qPCR 实验?怎么优化操作来减小实验失败的概率呢?我们为大家准备了一套有关 qPCR 实验准备和操作全过程的经验包,满满的小 tips,保证实用!
友情提示:通读全文可极限避雷!文末附实用数据计算表格模板,文末还有礼包等你领取!
一、前期保姆式准备,实验期间有备无患!
1. 实验仪器:移液枪、qPCR 仪要定期校准(较准周期一般是 1 年),保证仪器准确性。
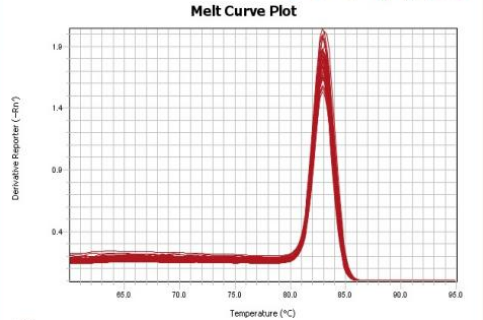
2. 引物:引物设计后进行有效性验证,选取扩增效率在 90%~110% 之间,且融解曲线单峰的引物,保证其高效的扩增效率和特异性。
3. 内参:如何选择、如何验证?
选择:
(1)通过已发表文章查找相同物种的内参,在实验体系上进行测试;
(2)选择常见的内参,在实验体系上进行测试;
(3)内部控制基因(Internal Control Genes,ICG)库中查找内参。
验证:
(1)尽可能选用多个内参同时进行实验;
(2)通过在不同样本处理上的表达差异检测情况,来选择合适的内参,选择差异不显著的内参作为后续实验内参;
4. 样品 cDNA :cDNA 模板需要稀释吗?应该稀释多少倍进行定量?
没有具体的稀释参考倍数,理论上 cDNA 每稀释 10 倍 CT 值变大 3.3,可以根据这个规律进行合适的稀释。可以使用 cDNA 原液、10 倍稀释液、100 倍稀释液等梯度稀释模板进行定量实验,根据规律选择 CT 值落在 18~28 范围内的稀释倍数。
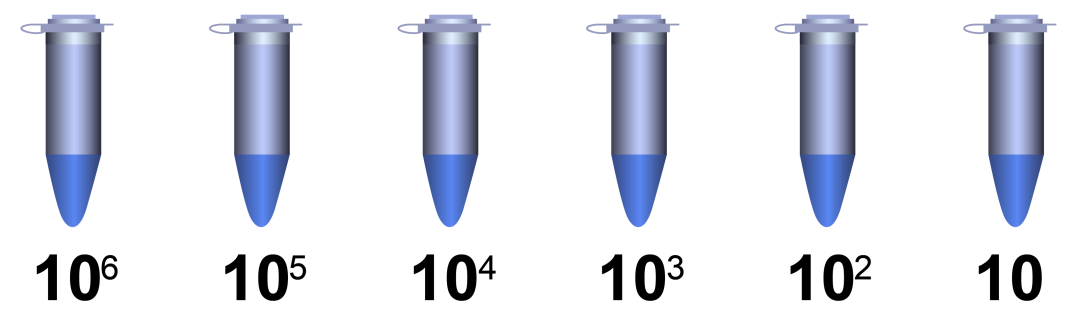

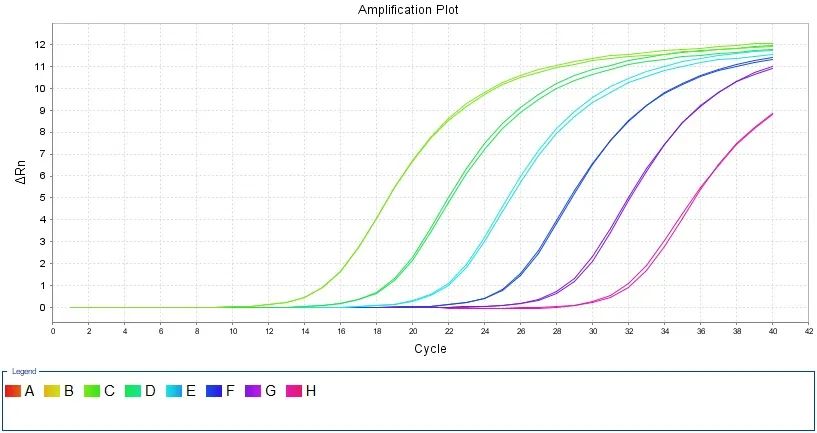
注:当使用 cDNA 原液进行检测的时候,使用量不能超过 qPCR 反应体系的 1/10,因为 cDNA 中包含很多抑制 qPCR 的组分,过大体积会抑制反应的进行。
二、提前排版 + 预混,准确加样不糊涂!
举个例子 :
:
1. 实验目的:比较未处理(对照组)和经处理后(处理组)的样本中某基因的表达变化。
2. 实验分组与排板设计:
对照组和处理组除目的基因检测还需引入内参和 NTC(无模板阴性对照,用于排除实验体系中是否存在污染),每个处理做三个复孔,排板如下:

3. 实验体系(以 Vazyme #Q712 推荐加样体系为例):

4. 体系配置方案:
(1)采取大体积配置试剂预混 Mix 溶液,可以增加复孔的重复度,减小误差。
Mix 1 两管:qPCR Mix + 引物 [内参(含 NTC)/ 目的基因(含NTC)]
Mix 2 两管:水 + cDNA 模板(对照组 / 处理组)

(2)处理组、对照组每孔加样体积:10.8 µl(Mix1)+ 9.2 µl(Mix 2)
NTC每孔加样体积:10.8 µl(Mix 1)+ 9.2 µl(ddH2O)
注:
① 一般会多配一些样品,这样保证最后每个孔都能有同等体积的液体;
② 预混后要涡旋离心,使其混匀;
③ Q712 为通用型试剂,无需在不同仪器上调整 ROX 的浓度。若所用试剂为非 ROX 预混型试剂,且仪器需要 ROX 进行校正(如 ABI stepone),需要在加样时注意添加 ROX。
5. 加样小 tips:
① 加样环境:qPCR 实验反应灵敏度高,所以配置预混液的过程应均在超净工作台中进行,防止污染;
② 配置条件:预混试剂在冰上操作,并避免强光直射,减少体系配置过程中导致模板降解、酶活降低以及荧光淬灭的可能;
③ 加样顺序:先加大体积,再加小体积液体;先加 NTC,再加模板。减小操作误差和污染风险;
④ 加样方式:
➣ 小体积加样可以采取移液器二档吸液一档出液(也就是说按到底吸液,出液的时候不要按到底),若不进行枪头更换,下个孔就是一档吸一档打,这样可以提高加样精确度和复孔的重复度;
➣ 如果离心管已有液体了,再加小体积的时候,把枪伸到液面下打,可以避免液体在枪头内残留;
➣ 吸液体的时候枪头不要没入液面下太深,并选低吸附枪头,减少枪头吸附引起的误差。
三、机器程序检查全面,不放过任何细节!
以诺唯赞 Q712 反应程序、ABI Q3 仪器进行设置为例:

1. 上机前检查:
✔ 注意管材中有无气泡,若存在气泡需轻轻弹去,然后瞬时离心;
✔ 不要在管口对准的管盖部分做标记,影响荧光信号采集。
2. 上机程序设置检查:
✔ 检查程序设置的温度、时间、循环次数、检查反应体积是否填写正确,以及是否设置荧光采集,否则会出现无扩增曲线的情况;
✔ 仪器类型不同,融解曲线采集程序不一定相同,使用仪器默认融解曲线采集程序即可。
四、数据无脑计算表格,照着来就老 OK 了!
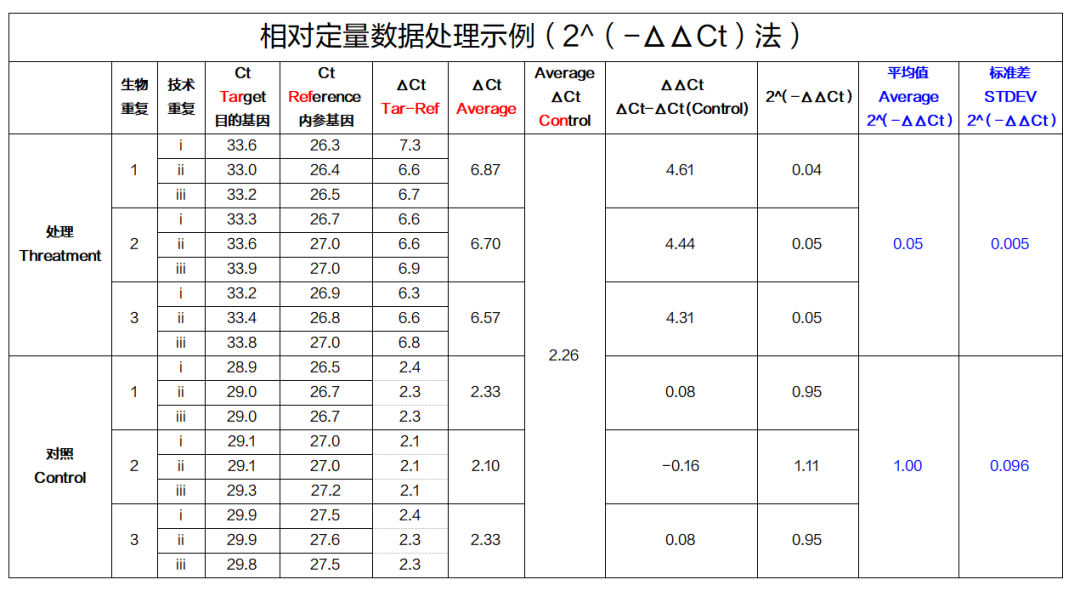
怎么样
 ,看完是不是觉得自己的 qPCR 十拿九稳了?现在更有诺唯赞送好礼助力!
,看完是不是觉得自己的 qPCR 十拿九稳了?现在更有诺唯赞送好礼助力!
活动一:参与 Vazyme「曲线 SHOW TIME」活动赢取百份惊喜好礼
时间:2022 年 9 月 27 日至 10 月 23 日
诺唯赞已于 9 月 27 日开启「曲线 SHOW TIME」活动,活动会收集各位客户使用 Vazyme #qPCR 系列产品的扩增曲线图片和点赞视频(参考活动页示例拍摄),并根据曲线和视频质量进行评比,华为无线蓝牙耳机、Dior 花漾小姐香水、小米智能音响、罗技键盘套装等超多惊喜大礼等着你!手中没有试剂怎么办?点击参加活动二,免费领取试用装!
现在点击「阅读原文」或识别下方二维码即可参与 Vazyme「曲线 SHOW TIME」活动,期待优秀的你前来参与!

活动二:试用福利
现在识别下方二维码即可免费申请试用装「Taq Pro Universal SYBR qPCR Master Mix(Q712)」
▼ 扫码免费申请试用 ▼

关于 Taq Pro Universal SYBR qPCR Master Mix(Q712)
平台值高:对于表达量较低或模板量少的体系更容易扩增出来,且荧光值易于检测,扩增曲线的平台值更高
特异性好:添加了特异性优化因子,降低引物二聚体出现的概率,使得扩增结果更可信
全平台通用:特殊参比的 ROX 染料,适用于多种 qPCR 仪器,无需在不同仪器上调整 ROX 浓度
如有疑问,欢迎联系您身边的诺唯赞人,诺唯赞将持续为您提供更优质的产品与服务!如果您有任何需求都可致电 400-600-9335!
内容策划:王丹琦
内容审核:吴军
题图及文中图表均来自诺唯赞
点击「阅读原文」,参与活动~
