「真的,我想哭了!RT-qPCR 实验结束,总能发现有些样本的 Ct 值明显延后,有几个甚至没有扩增,明明每一步都按照 SOP 规范操作,怎么就出来这么一个结果呢,也不知道哪个步骤出错了,无从下手,真是让人头大......」
屋漏偏逢连夜雨,偏偏导师还来问我实验进展:

导师

你的实验进展怎么样了?
不太好,有些样本的扩增结果不好。


我

导师

按照你师姐给你的 SOP 操作了吗?
我按照 SOP 里的实验步骤一步步操作,结果就是不太好。


我
这时候师姐也来凑热闹。

师姐

我看师弟之前做了性能验证,方法上应该没问题,基因表达分析实验的起始步骤是 total RNA 提取,提取产物有没有检测?
用分光光度计检测了,都是正常的。


我

师姐

那 RNA 完整性测了吗,样本抑制物检测做了吗?
我......没做过。


我
后来,师姐完整地教了我一遍,并给了我下面这份「不外传」的秘密宝典。
一、样本质量是 RT-qPCR 实验成功的关键因素之一
使用高纯度(不含 DNA 和蛋白质及抑制物)和高度完整(无降解)的 RNA 进行实验是整个 RT-qPCR 实验流程中很关键的环节。降解或污染的 RNA 会产生低质量的 cDNA,从而导致 qPCR 反应效率低下,并导致不准确的低质量数据,具体表现为:
● RNA 不纯将导致对下游 PCR 反应的抑制,Cq 将右移,产生数据偏差。
● 若 RNA 发生降解,将导致不正确的结果。
● RNA 的纯度和完整性是不相关的两个指标,都需要进行检测以确保高质量的 RNA 用于下游实验。
对于 RT-qPCR,要尽力避免所谓的「garbage in = garbage out」。获得高品质 RNA 需要注意:
1、尽量避免 RNA 酶污染,使用无 RNA 酶的耗材和试剂,戴手套口罩,建议将提取和扩增的场所分开。
2、尽量减少采样时间,样品处理后快速冷冻,可以加入 RNA 保护剂。
3、RNA 提取过程中可以使用 RNA 酶抑制剂。
4、样本存储过程中避免反复冻融。
5、必要的情况下,分装 RNA,并在乙醇或异丙醇中于 -80 ℃ 下保存。
二、RNA 样本质量评估方法
判断一份样本是否合格,需要考察 RNA 浓度(总量)、RNA 纯度、RNA 完整性、抑制物(污染物质)等方面。常用的方法如下:
1、UV 吸光度检测
260 nm 吸收值计算 RNA 浓度,再乘以体积可以计算 RNA 总量;测量 260 nm/280 nm 吸收值的比值,用于评估 RNA 纯度,纯度的要求如下:
● A260/280 = 2(1.8~2.2;<1.8,说明有蛋白质残留;>2.2,说明 RNA 可能发生降解)
● A260: 0.15~1
● A260/230 = 2.5(> 2.0)
2、电泳分析 RNA 条带
通过琼脂糖凝胶电泳可以大致评估 28 S 和 18 S 的比值,用于检测 RNA 完整性。判断合格的标准是 28 S 和 18 S 条带明亮、清晰,且 28 S:18 S ≈ 2:1;如果 RNA 降解,则会出现弥散状条带;如下图所示:
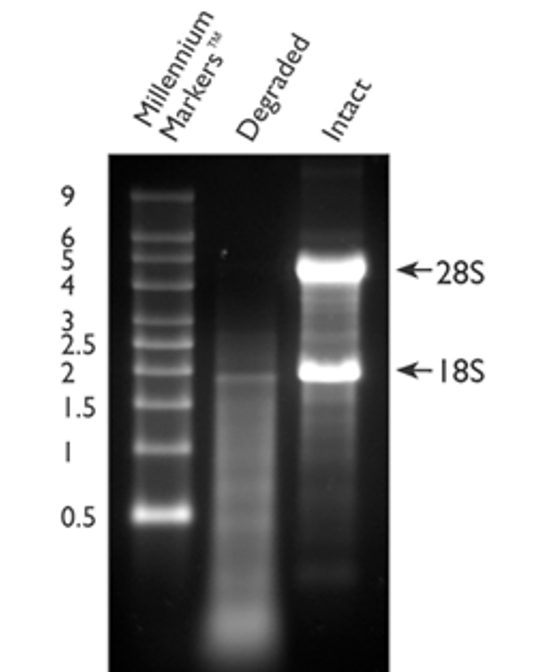
图 1. RNA电泳条带
但电泳分析 RNA 质量存在以下不足:
● 需要相对大量的 RNA(5~10 μg),当 RNA 总量较低时,可能无法开展。
● 肉眼评估,比较主观
● 耗时长,耗费工作量
● 通量低,不适合大量 RNA 样本分析
● 不能反映是否存在 g DNA 污染
3、微流体毛细管电泳系统(分析 RNA 浓度和完整性)
目前已经有成熟并广泛应用的生物分析仪,如 Agilent 2100、Experion™ 自动电泳工作站等。
此外还可以采用 3`:5` assay(检测提取产物中 GAPDH mRNA 的完整性来代表所有 RNA 的完整性,分析 RNA 完整性)、SPUD assay (分析 PCR 抑制剂)、NRT PCR assay(分析 gDNA 残留)等等。
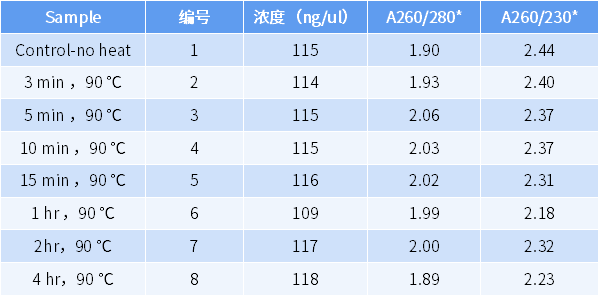
值得注意的是,RNA 的纯度和完整性是两个不相关的指标,两者没有必然的内在联系,不能想当然的认为分光光度计结果正常, RNA 完整性就没问题。我们来看一个例子:从人肝癌样本提取总 RNA,在 90 ℃ TE 缓冲液中孵育不同的时间,同时进行 RNA 纯度检测,发现均合格。
表 1. 肝癌 RNA 样本浓度和纯度的检测结果
但 Experion Virtual Gel 电泳结果显示,6、7、8 号样本发生了严重降解。所以分光光度计结果正常并不意味着 RNA 完整性就好。
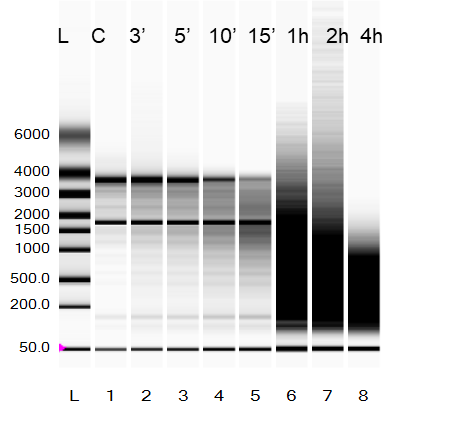
图 2. RNA 电泳结果
三、如何判断 RNA 样本存在抑制物?
提取纯化 RNA 具有挑战性,因为各种细胞和组织中普遍存在核糖核酸酶(RNase),它们会迅速降解 RNA。此外,尿素、盐、苯酚、肝素等抑制性成分和在取样或 RNA 提取过程中使用的试剂残留也可能会影响 PCR 结果。有调查表明,只有 6% 的研究人员测试他们的核酸样品是否存在抑制物,抑制物检测是时候引起大家重视了。
Tania 等人开发并改进了一种方法,称之为「SPUD」测定法。SPUD 可以鉴定 RNA 或 DNA 样品是否存在抑制剂。当需要分析大量样品时,或者当目标基因的低拷贝数较低时,不能梯度稀释样品时,该检测方法特别有用。该试验可以避免假阴性,并使得阴性结果的数据报告更为可信。
SPUD assay 一般由人工模拟模板和一对特异性引物组成,在染料或探针的作用,扩增 SPUD 模板,产生特征性 Cq。纯净样品的 Cq 与 SPUD 对照相同,而在被污染的样品中,Cq 值将升高。如下图所示:SPUD + RNA2 与对照 Cq 值相差为 3,则可判断提取产物含有抑制物,且不能忽略。
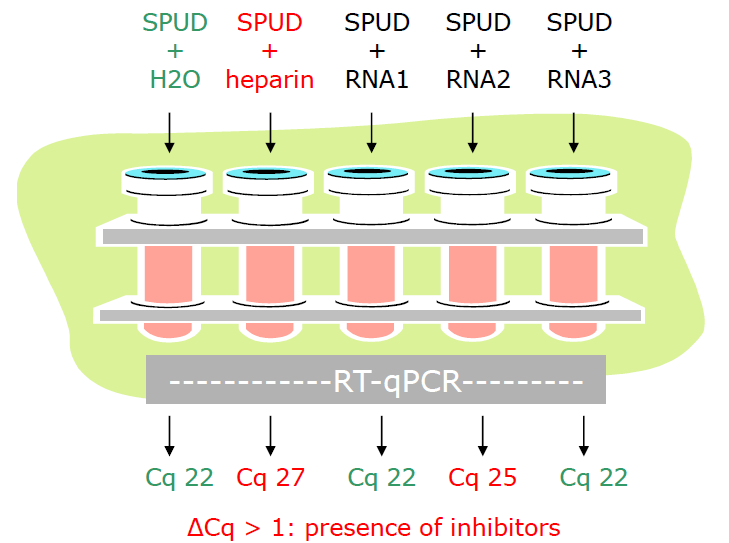
图 3. SPUD 检测 RNA 样本中抑制物的原理
通过 SPUD 试验检测 PCR 抑制物的实例:
(A)从 HeLa 细胞提取 RNA 的扩增曲线图,加入纯水的对照(a)、模板 RNA(b)以及存在痕量抑制物苯酚(c)。
(B)从福尔马林固定石蜡包埋包埋样品(FFPE)提取的 RNA 和纯水(W)下进行 SPUD 试验,30 个样品中有 5 个存在显著的抑制。
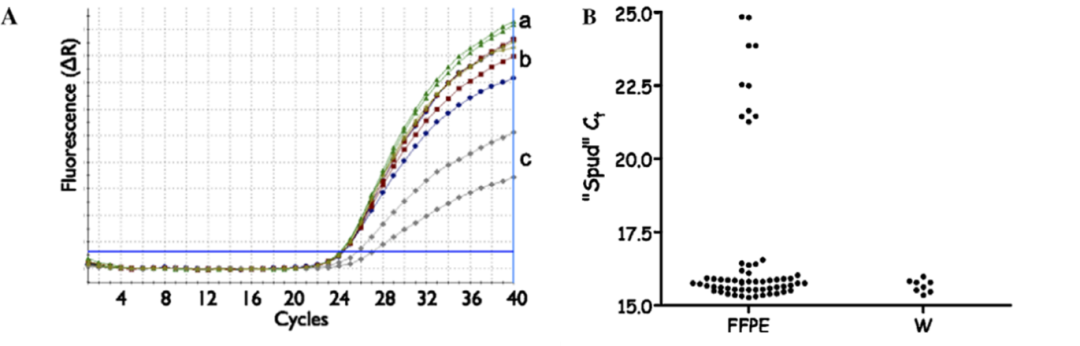
图 4. SPUD 应用实例
一入生物深似海,从此处处是知识,本期的内容您掌握了吗,期待下期再见~
Bio-Rad 为您提供 Aurum Total RNA 提取试剂盒,可从各种原始样本(如培养细胞、细菌和酵母,以及植物和动物组织)中提供高产量且完整的 RNA。
图 5. Aurum Total RNA 提取试剂盒
Bio-Rad,您身边的 qPCR 专家!
* BIO-RAD 是 「BIO-RAD LABORATORIES, INC.」 在特定区域的商标。
* 本产品仅用于科研用途,不用于临床诊断。
内容审核:邹礼平
项目审核:周育红
题图来源:图虫创意
参考资料:
[1]. Taylor, Sean C., et al. The ultimate qPCR experiment: producing publication quality, reproducible data the first time.[J] Trends in Biotechnology 37.7 (2019): 761-774.
[2]. Nolan, Tania, et al. SPUD: a quantitative PCR assay for the detection of inhibitors in nucleic acid preparations.[J] Analytical biochemistry 351.2 (2006): 308-310.
[3]. Bio-Rad Bulletin 5279:Real-Time PCR Applications Guide
[4]. Bio-Rad Bulletin 6894:Tips, Tricks & Best Practices The Ultimate qPCR Assay Design Guide