
师兄

你最近怎么愁眉不展的?课题评估不顺利?
也不是,就是这个课题需要以肿瘤类器官为模型。我查了一些资料,信息量太大了,不知道该怎么筛选 。
。


师弟

师兄

哈哈哈,原来是这样,你为啥不问我,你师兄可是隐藏的「类器官培养大师」。
这样吗?那太好了,师兄你快点教教我吧
 。
。


师弟

师兄


太全了,真是雪中送炭!!!


师弟
肿瘤类器官经过近十年的发展,未来大有可为。其可以模拟肿瘤的病理特征,保留遗传稳定性,是肿瘤病理机制研究的法宝,是药物开发的利器,是个性化诊断和治疗的「替身」。
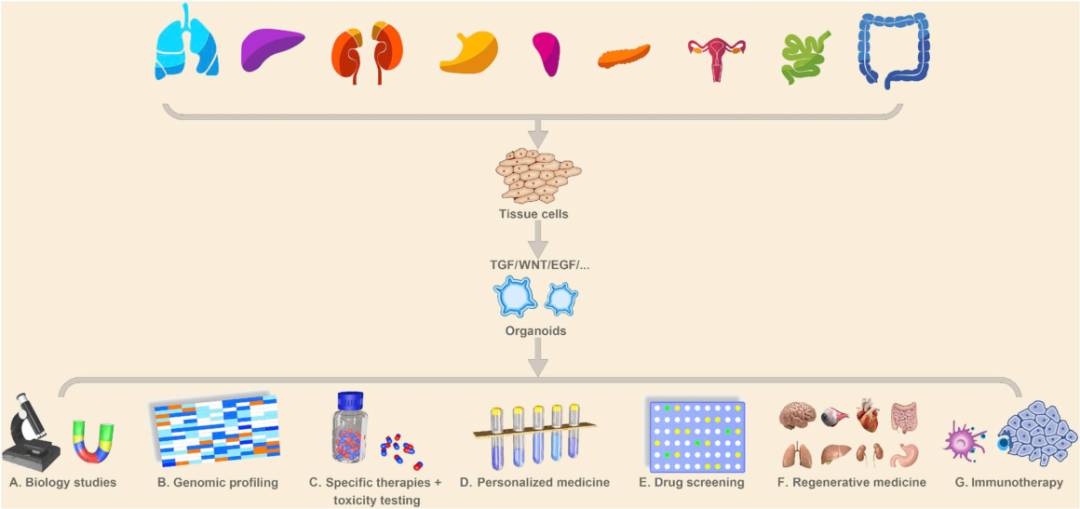
图 1:肿瘤类器官的应用[21]
Bio-Techne 推出肿瘤类器官的培养流程,与诸位共享。本方案修改自:Driehuis E, et al. Nat Protoc. 2020。
人原代组织准备
注意
涉及到人原代组织的研究必须符合所有相关的机构和政府规定。在收集人原代组织材料之前,必须得到所有受试者的知情同意。
1)收集人原代组织块,按活检部位和/或组织类型(比如正常组织和肿瘤组织)分开放在 50 mL 锥形管中,每管含有 45 mL 冰预冷的 adDMEM/F12+++ 培养基【「+++」表示含有以下三种试剂:adDMEM/F12 培养基 + 100 U/mL penicillin-streptomycin + 10 mM HEPES + 1× (vol/vol) GlutaMAX,在 4°C 保存 ≤ 1 月】。adDMEM/F12+++ 培养基中建议加入 10 μM ROCK 抑制剂(Tocris,Y-27632,货号 1254),以提高细胞存活能力。将组织样本保存在这种培养基中,置于 4°C,直至开始分离。
注
根据原代组织来源的不同,组织块可在 4°C 下保存至多 72 小时,而不会造成类器官生长的明显损失,但是建议尽快进行下一步。
2)评估获得的组织块是否仅由上皮组成,还是包含脂肪或肌肉组织。如果包含脂肪或肌肉组织,在解剖显微镜下用手术剪刀或手术刀和镊子尽可能去除非上皮成分。
注
非上皮组织可能会延长消化成单细胞的时间,或导致过高估计具有类器官形成能力的(上皮)细胞数量。
3)在 10 cm 的细胞培养皿中,使用手术剪刀或手术刀将组织切成 1~3 mm3 的小块。
4)根据肿瘤类型适当消化组织。消化液一般以胶原酶为主(肠:II、IV 型;肺:I、II 型;肝:IV 型),浓度为 400~1,000 U/mL,附以分散酶,核酸酶 5~20 U/mL。消化液现用现配,37 ℃ 预热。在消化过程中添加 10 μM ROCK 抑制剂可提高生长效率。如下为结直肠消化液举例可供参考。
表 1. 结直肠消化液配方示例[22]
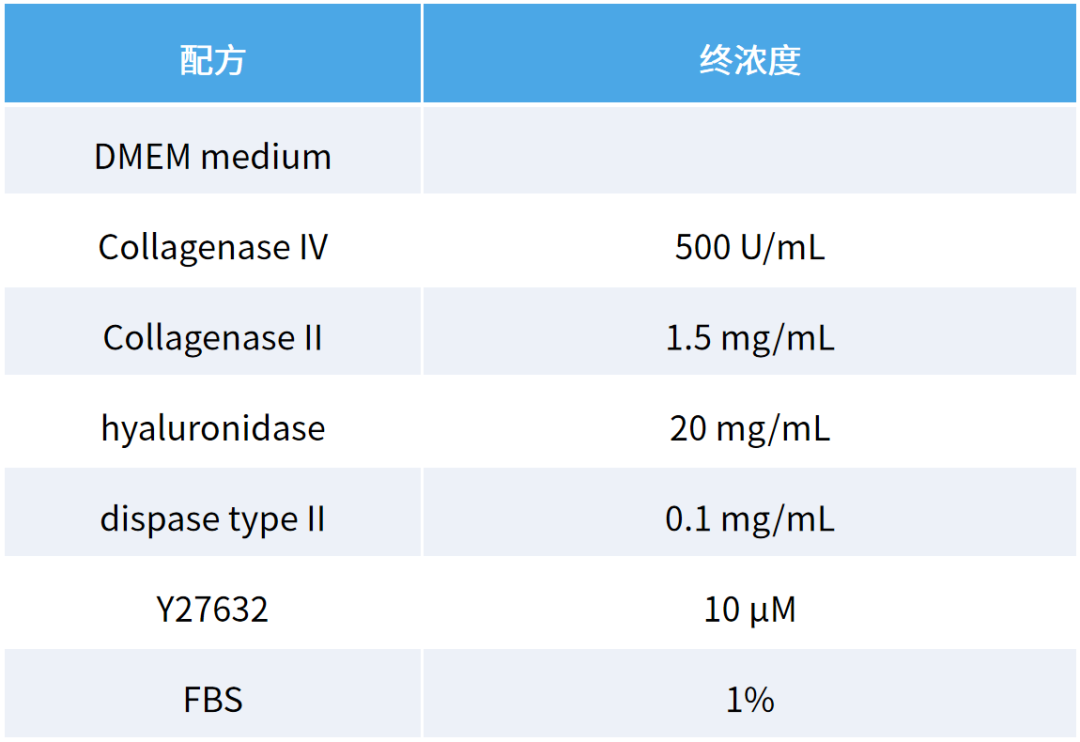
仔细观察消化情况,对于 2 小时以内的孵育,每 10~15 分钟混合一次,大力晃动,并用 P1000 移液器上下吹打混合物。对于过夜孵育,将混合物置于摇床上。不同类型或者量的组织,消化时间不同,消化时间不宜过长。例如穿刺样本为 10 min,小的组织碎片团为 30 min~1 h。
注
仔细观察消化情况,因为过度消化会显著降低生长效率。根据经验,在观察到细胞簇(由 2~10 个细胞组成)的混合物时,消化就完成了。在开始培养新的组织类型时,建议在消化过程中取少量样本并铺板,以确定这种特定组织的最佳消化时间。
5)当混合物变得浑浊且剩余的组织碎片被破碎时,使用 P1000 移液器上下吹打 10~20 次,进一步促进组织破碎。从顶部加入 10 mL adDMEM/F12+++ 培养基,并在 4℃ 下以 200 g 离心 5 分钟,对细胞进行清洗。
6)将沉淀重悬在 10 mL adDMEM/F12+++ 培养基中,并用 70~100 μm 细胞滤网进行过滤。
7)对重悬和过滤后的细胞进行离心,在 4°C 下以 200 g 离心 5 分钟。
注
如果过筛后的细胞沉淀呈红色,可能有血红细胞污染,建议加入 5 mL 红细胞裂解液 4°C 处理 5 分钟。完成裂解后,在 15 mL 管中加满 PBS 清洗一次,然后在 4°C 下 500 g 离心 3 分钟。
类器官培养
8)吸出上清液,将沉淀重悬在 BME(推荐 R&D Systems® Cultrex RGF,货号 3536-005-02、BME001-10)中。BME 应置于冰上,以防止其凝固,因而操作时应当迅速。BME 的用量取决于沉淀的量。大约 10,000 个细胞应接种在 40 μL BME 中。
注
切勿过度稀释 BME【BME 应当 > 70%(体积比)】,以确保能形成固化液滴。
9)将类器官和 BME 的混合物滴在预热的 24 孔悬浮细胞培养板的底部,每滴约 10 μL。在每孔中放置 3~4 滴(BME 包被方法请点击了解)。
注
● 类器官一旦悬浮在 BME 中,应尽快进行铺板,因为 BME 可能在管中或移液器吸头中凝固。
● 培养板应置于 37℃ 的加湿培养箱中,预热过夜。如果未正确预热,BME 液滴会立即平铺在培养板的表面,并且类器官更容易附着在培养板的底部。
10)将培养板置于 37°C、5%(体积比)CO2 加湿培养箱内,孵育 20~30 分钟,使 BME 凝固。
11)准备所需量的类器官培养基(培养基配方请见下表),并添加 10 μM ROCK 抑制剂和原代细胞抗生素 Primocin(100 μg/mL),然后将培养基置于 37°C 水浴中。对于头颈部类器官,在人头颈部类器官培养基中额外添加 0.5 μg/mL 卡泊芬净(caspofungin)。
表 2. 肿瘤类器官的培养基配方示例(终浓度)[1-20]
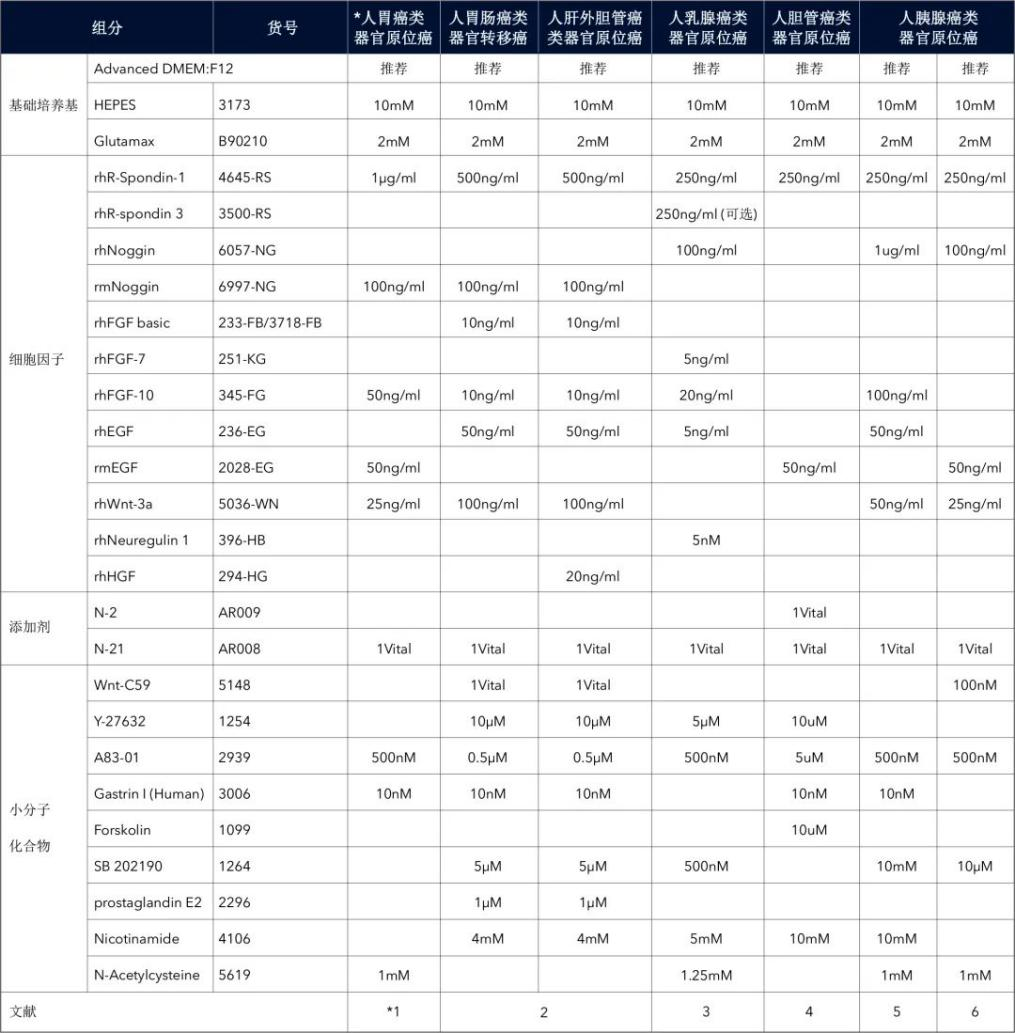
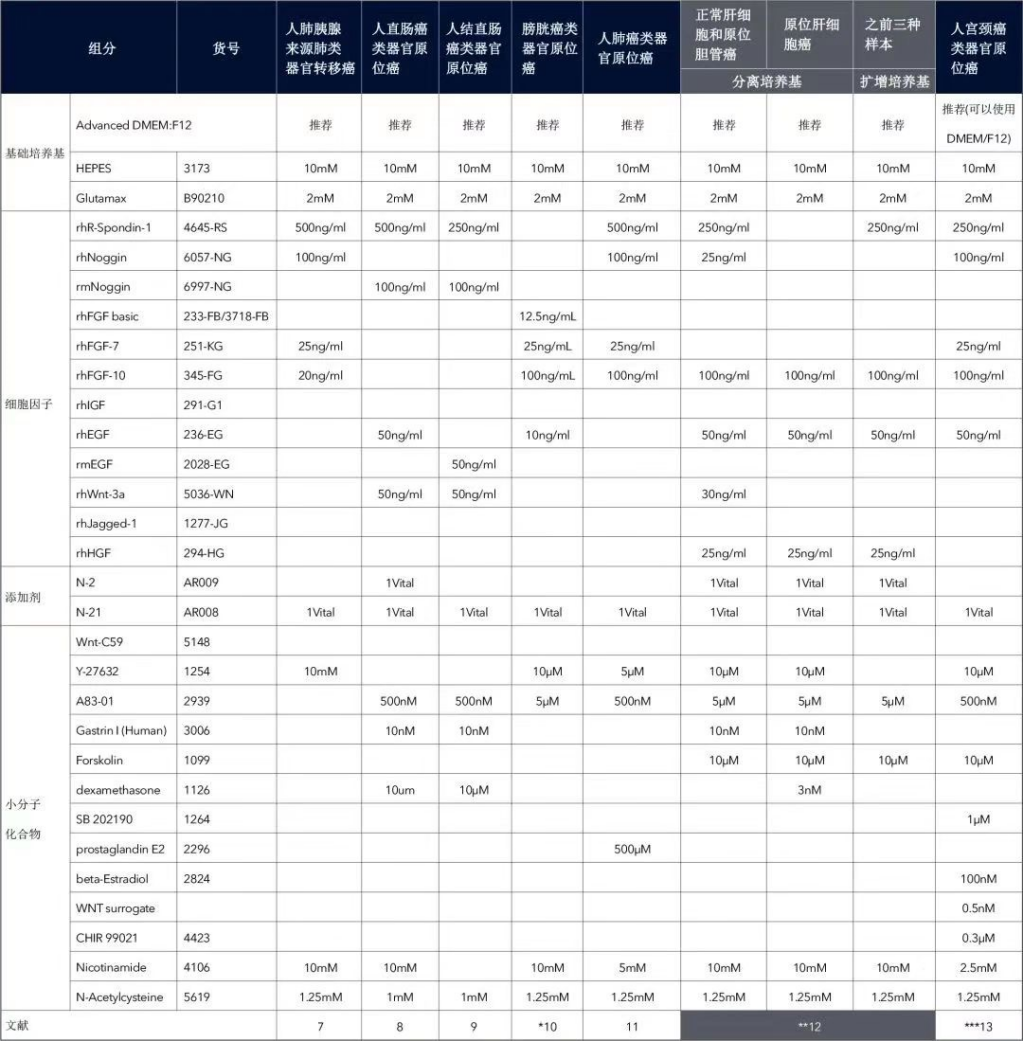
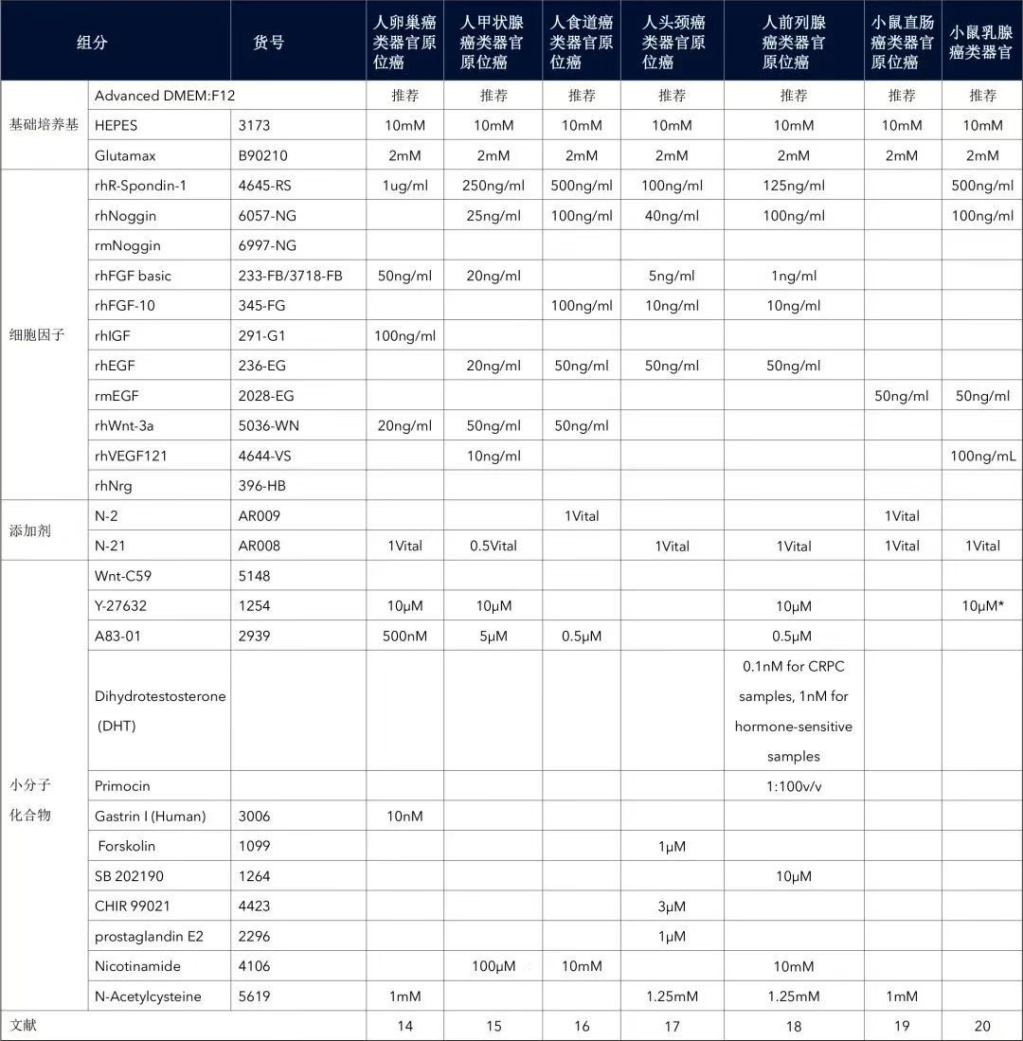
(左右滑动查看更多)
* 胃癌补充:为了富集胃类器官,单细胞消化时添加 Nutlin-3(3 mM,R&D Systems#3984)但无 Y-27632,培养在无 A83-01、EGF、FGF10,但是有 TGF-beta 1(10 ng/mL),R&D Systems#240-B)的完全培养基中处理 1 周。为了抑制内生 Wnt 的分泌,类器官用 100 nM C59(100 nM,R&D Systems#5148)处理。
* 膀胱癌补充:冻存液为 50% FBS、10% DMSO 和 40% Adv DMEM/F-12。
** 肝癌补充:
1)使用 100 μm 滤网在 300~500 g 下离心 5 分钟。
2)处理的肝癌样本(含胆管癌、肝细胞癌),建议使用 1:1 混合的肝组织经典分离培养基和肝细胞癌分离培养基,因为胆管癌适合在经典培养基中生长。
3)分离和扩增培养基每周换 2 次,都加入 1% penicillin/streptomycin。
4)健康肝 1 周后换成相应的扩增培养基。
5)胆管癌和肝细胞癌 2~3 周后换成扩增培养基,依据肿瘤细胞生长情况来定。
*** 宫颈癌补充:
1)使用 70 μm 滤网 1,200 g 下离心 5 分钟。
2)最初的 2~3 代,建议添加 100 mg/mL Primocin 来防止污染。
注
该配方根据参考文献整理,仅供参考,建议查询更多文献确定最终配方。
12)一旦 BME 液滴固化(30~60 分钟),翻转培养板并在每孔中小心加入 500 μL 类器官培养基。
注
切勿直接在 BME 微滴的顶部加入培养基,因为这可能会破坏微滴结构。
13)将培养板置于 37℃、5%(体积比)CO2 加湿培养箱内。
14)每 2~3 天更换一次培养基,从各孔中小心吸出培养基,然后加入新鲜的预热培养基。在前两次传代时,在培养基中添加 ROCK 抑制剂和 Primocin。
注
● BME 微滴可能会从悬浮培养板上脱落,在培养基中「游动」。在这种情况下,我们建议对类器官进行重新铺板,不要使用 TrypLE 来解离类器官。密切监控类器官的形成。理想情况下是在最初铺板后的 12~14 天内对类器官进行首次传代。
● 切勿过早传代(Splitting)类器官,因为这可能会造成培养终止。
● 在第一次传代时,确保培养物达到最佳密度(根据经验,每 40 μL 培养物中含有 10,000 个细胞)。
肿瘤类器官的传代、冻存及复苏等,
Bio-Techne 将在后续推文中与您分享,
敬请期待!
如需购买类器官培养相关试剂、培养基,
可识别下方二维码或点击「阅读原文」,
联系经销商购买~

关于 Bio-Techne:
Bio-Techne 是生物公司中率先登陆纳斯达克(Nasdaq)的拓荒者之一,2007 年,在上海成立中国分公司,助力中国生命科学事业的发展与腾飞,目前旗下已拥有 R&D Systems®、Novus Biologicals®、Tocris®、ProteinSimple®、PrimeGene® 和 Advanced Cell Diagnostics 等众多一线品牌。
Bio-Techne 历经几十年的发展,在不断创新的生命科学领域展现出了强大的实力和高度的专业性,将匠人精神发挥到极致,严苛的质控环节甚至可以保证产品在十余年间的批次稳定性。这种科学匠心使 Bio-Techne 屡获殊荣,如:2017 年,Bio-Techne 被英国高等教育部门指定为官方抗体供应商;2018 年,Bio-Techne 荣获 CiteAb Awards 含金量较高的「研究者之选」奖;2019 年,Bio-Techne 横扫 CiteAb Awards「研究者之选」、「年度 ELISA 试剂盒公司」、「地区取得成功的抗体公司」三项大奖;2020 年,Bio-Techne 再次荣获 CiteAb 颁发的「研究者之选」奖。

内容审核:王丹琦
项目审核:陆雯芸
题图来源:图虫创意
参考文献
[1]. Divergent Routes toward Wnt and R-spondin Niche Independency during Human Gastric Carcinogenesis.
[2]. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers.
[3]. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity.
[4]. Establishment of Patient-Derived Organoids and Drug Screening for Biliary Tract Carcinoma.
[5]. Organoid Models of Human and Mouse Ductal Pancreatic Cancer.
[6]. Human Pancreatic Tumor Organoids Reveal Loss of Stem Cell Niche Factor Dependence during Disease Progression.
[7]. Human Lung Adenocarcinoma-Derived Organoid Models for Drug Screening.
[8]. A rectal cancer organoid platform to study individual responses to chemoradiation.
[9]. A Colorectal Tumor Organoid Library Demonstrates Progressive Loss of Niche Factor Requirements during Tumorigenesis.
[10]. Mouse and human urothelial cancer organoids: A tool for bladder cancer research.
[11]. Long-term expanding human airway organoids for disease modeling.
[12]. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening.
[13]. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer.
[14]. Patient-derived ovarian cancer organoids capture the genomic profiles of primary tumours applicable for drug sensitivity and resistance testing.
[15]. Patient-Derived Papillary Thyroid Cancer Organoids for Radioactive Iodine Refractory Screening.
[16]. Organoid cultures recapitulate esophageal adenocarcinoma heterogeneity providing a model for clonality studies and precision therapeutics.
[17]. Patient-Derived Head and Neck Cancer Organoids Recapitulate EGFR Expression Levels of Respective Tissues and Are Responsive to EGFR-Targeted Photodynamic Therapy.
[18]. Organoid Cultures Derived from Patients with Advanced Prostate Cancer.
[19]. In vitro Organoid Culture of Primary Mouse Colon Tumors.
[20]. BRCA-deficient mouse mammary tumor organoids to study cancer-drug resistance.
[21]. Tumor organoids: From inception to future in cancer research.
[22]. Patient-Derived Organoids Predict Chemoradiation Responses of Locally Advanced Rectal Cancer. Cell Stem Cell.
[23]. Establishment of patient-derived cancer organoids for drug-screening applications.
▼ 点击阅读原文,快速联系经销商~