自 1918 年西班牙大流感到现在,一百多年间,流感一直是人类最强劲的对手之一。作为一种 RNA 病毒,流感病毒虽然结构简单,但其变异性和传播性似乎比人类的反应更快。
也因为这点,流感病毒蛋白研究的热度一直未减。近年来,针对流感病毒的研究已取得了诸多成果,在流感病毒的病原学、临床表现与传播方式、致病机制、检测方法和治疗方案等方面均有不同程度突破[1]。
而在上述研究中,几乎都少不了蛋白研究的身影,可以说蛋白研究在流感病毒领域的地位举足轻重。
流感病毒重组蛋白是疫苗生产所需的关键材料
世界卫生组织(WHO)每年上、下半年会分别公布下一季的北半球和南半球流感疫苗组分[2]。官方组织的下场加分也代表着流感疫苗研究的重要性。义翘神州已建立完善的跟踪体系,第一时间做出快速反应,制备新的疫苗组成重组蛋白,用于相关研究。
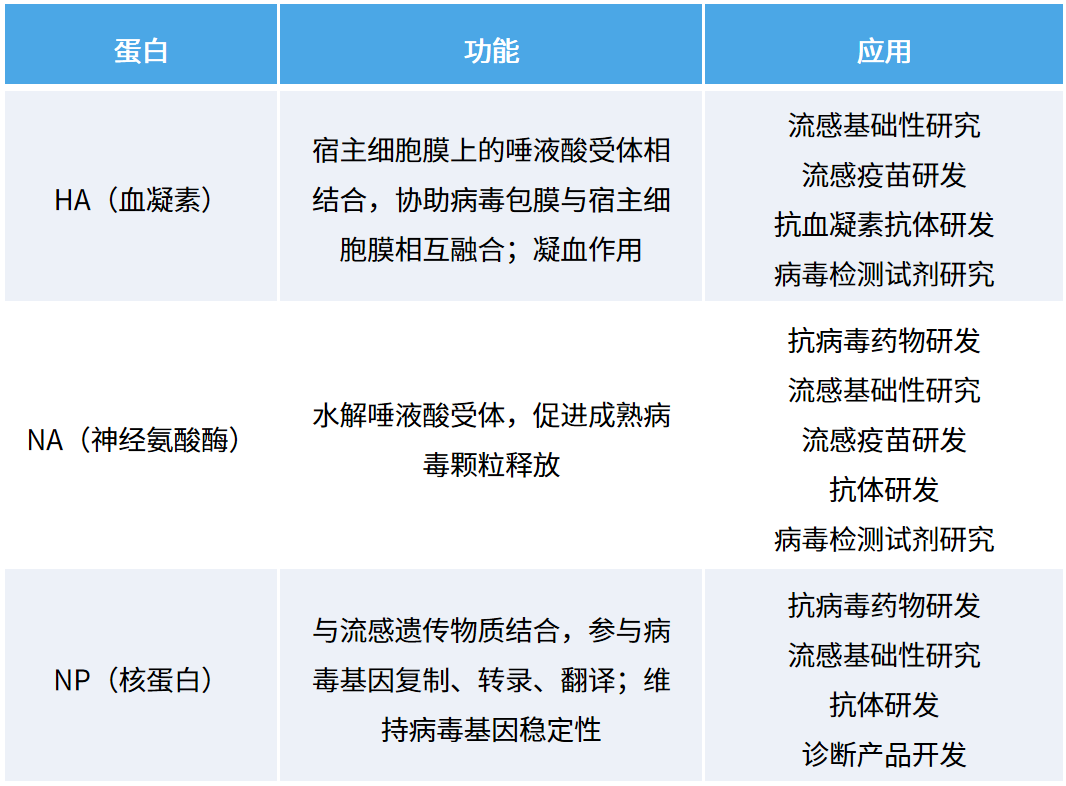
重组流感蛋白可在疫苗含量检测、疫苗生物效价检测以及毒理实验研究等疫苗开发的各个环节应用。其中关键的靶点蛋白在研究中也有重要作用,如 HA、NA、NP 等几个重要的靶点蛋白(如图 1 所示)。
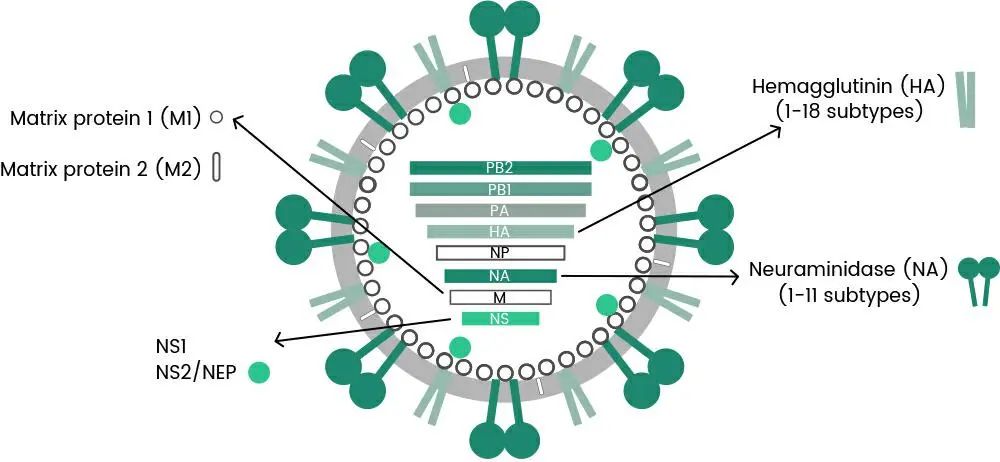
图 1:HA、NA、NP 相关蛋白功能及其构建的 WHO 推荐 3 种疫苗株[2]
应用重组蛋白进行 ELISA 检测,可以分析疫苗免疫后血清总抗体、中和抗体水平,以重组蛋白为对照品检测疫苗含量。
1. 新型 DNA 疫苗:新型 DNA 疫苗在应对流感病毒变异方面具有一定优势。Andersen 等人[3]将流感抗原直接靶向抗原呈递细胞(APC),结果显示 DNA 疫苗的功效与传统疫苗技术相当(如图 2 所示)。
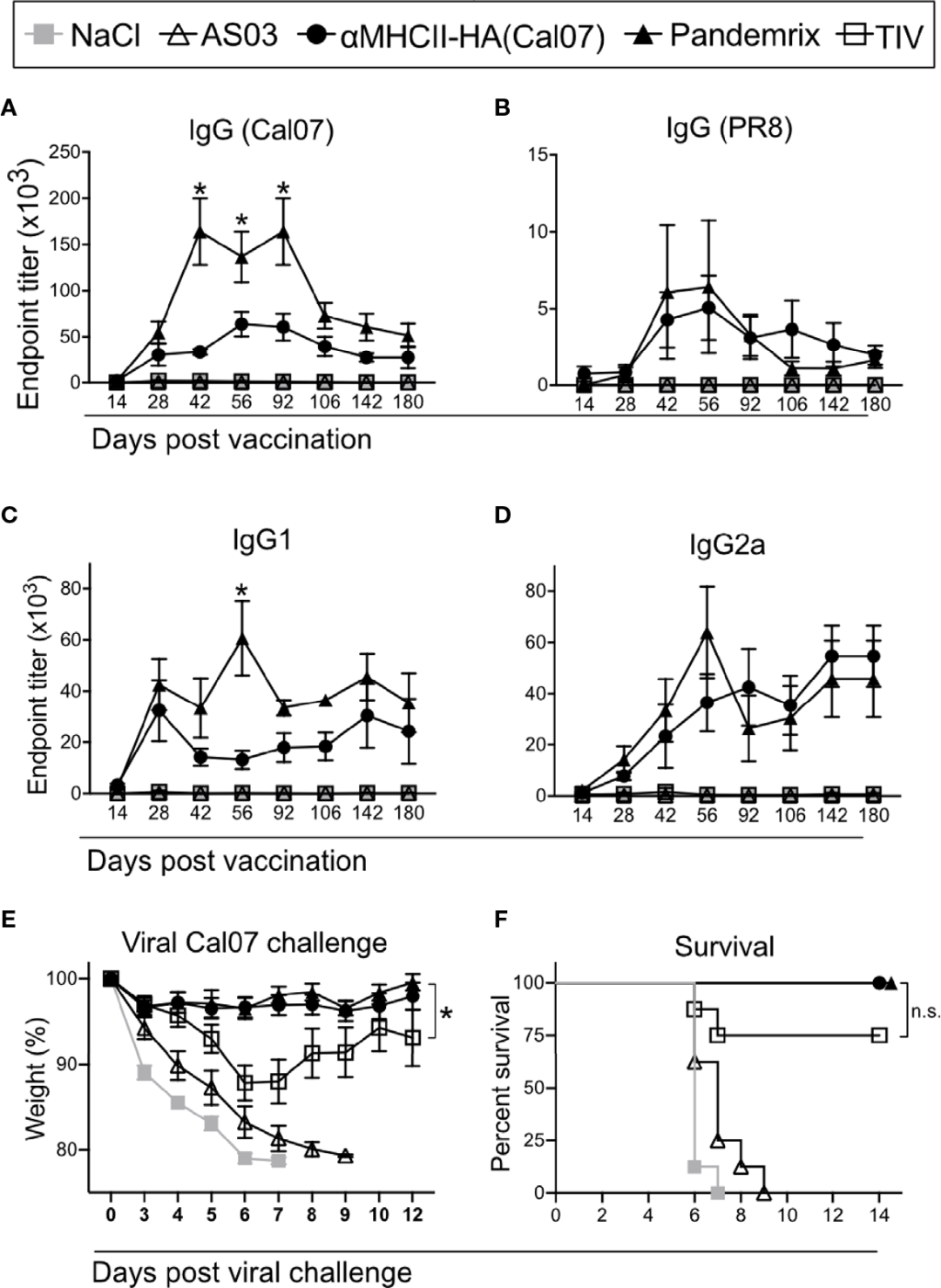
图 2:利用重组流感 HA 蛋白检测疫苗免疫后小鼠的血清抗体水平结果[3]
2. 通用型疫苗:通用型疫苗是流感疫苗开发的重要思路。Bangaru 等[4]研究发现抗体 FluA-20 能够进入流感蛋白稳定的三聚体 HA 区域,并使其分裂,从而病毒不能在细胞间传播(如图 3 所示)。
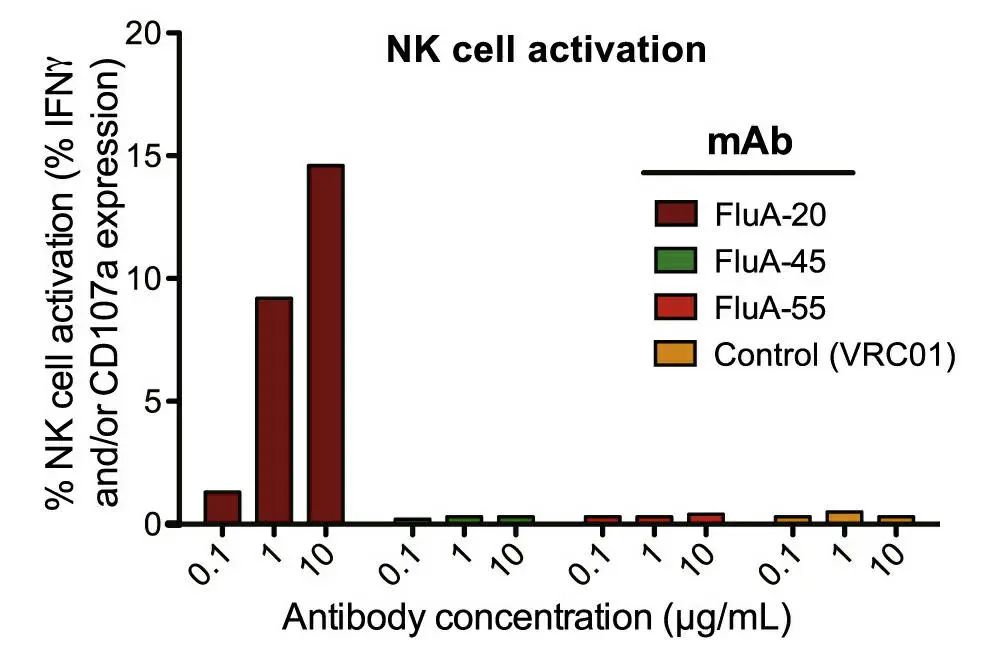
图 3:利用重组流感 HA 蛋白证实 FluA-20 可在体外活化 NK 细胞,诱导 ADCC 活性[4]
流感病毒重组蛋白是药物筛选的关键靶点
在药物研发过程中,HA 和 NA 蛋白发挥了关键作用。HA 蛋白介导流感病毒和宿主细胞膜融合,NA 蛋白促进成熟病毒颗粒释放,以及参与病毒 RNA 负责和转录过程的酶类,都是抗病毒药物研发的靶点。
比如以 NA 为靶点的药物有奥司他韦、扎那米韦,靶向 HA 的药物有阿比多尔。利用重组蛋白进行药效分析或筛选是药物开发常用的技术。韩国化学技术研究所[5]曾利用义翘神州的流感 NA 蛋白进行神经酰胺酶抑制实验,取得理想的研究结果。
流感病毒重组蛋白可作为诊断试剂中血清学检测方法原料
流感病毒目前的免疫学检测方法主要有血清学检测方法和抗原检测方法两种:抗原检测方法更适合快速现场检测和基层初筛;血清学检测方法会用重组蛋白检测血清中的抗体,这种方法多应用于回顾性分析。
图 4 是诊断原料中可用来筛选流感检测用抗体的重组 NP 蛋白。
图 4:利用重组流感 NP 蛋白的血清学检测方案
流感病毒研究中三种重要的靶点蛋白
通过以上几个案例大家可以看出,在流感病毒相关疫苗、药物甚至诊断试剂中,关键的靶点蛋白都发挥了不小的作用,我们也为大家总结了刚刚提到的 HA、NA、NP 几种流感病毒研究关键蛋白信息,帮助大家更好地了解及应用。(如表 1 所示)
表 1:流感病毒研究关键蛋白信息表
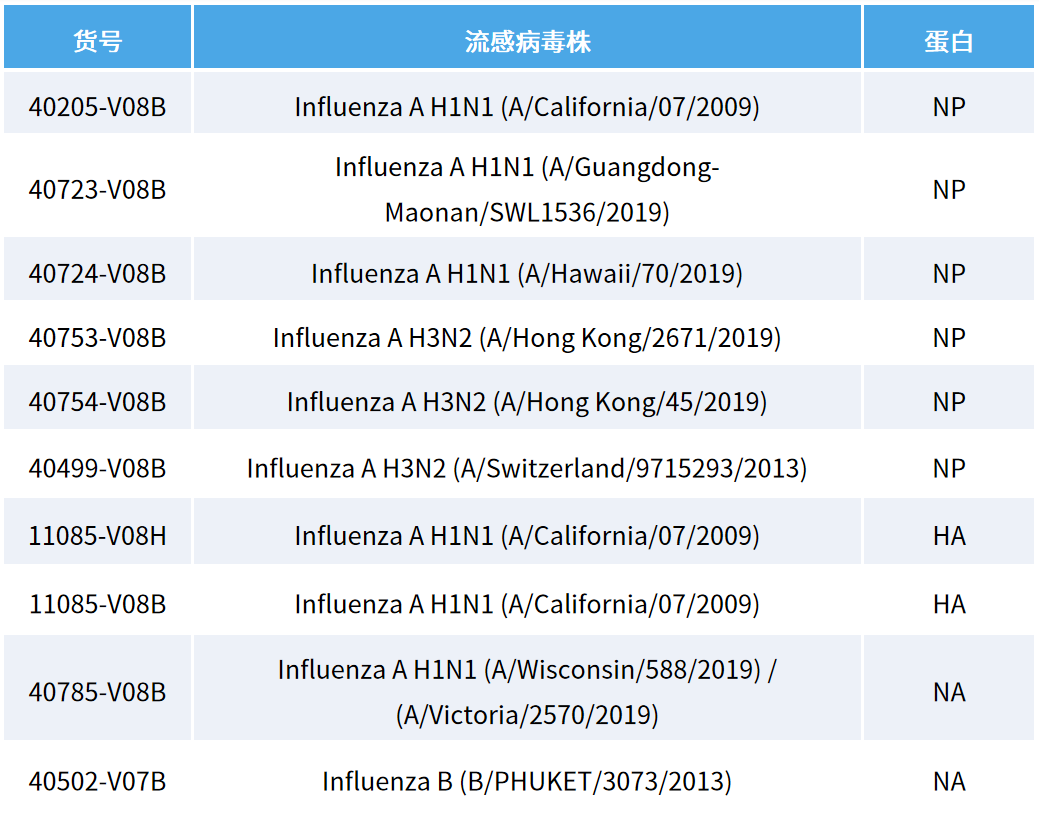
义翘神州已经成功构建上文中提及的 HA、NA、NP 相关蛋白,并可根据科研及生产需求提供定制服务(如表 2 所示)。
表 2:义翘神州可提供应用中用到的 NP、HA、NA 重组蛋白(His 标签)列表
除上述应用中提到的关键蛋白外,义翘神州可提供 2015~2023 流感疫苗重组蛋白,扫描二维码或点击阅读全文即可查看全部,同时,也支持根据您的需求进行定制。

内容策划:武妙兰
内容审核:周文
题图来源:站酷海洛
参考文献:
[1]. 马洲,关明,邢志芳,等. 流感病毒研究现状与进展[J]. 检验医学,2020,35(12):1315-1319. DOI:10.3969/j.issn.1673-8640.2020.012.027.
[2]. https://www.who.int/news/item/25-02-2022-recommendations-announced-for-influenza-vaccine-composition-for-the-2022-2023-northern-hemisphere-influenza-season
[3]. Andersen, et al. Pandemic Preparedness Against Influenza: DNA Vaccine for Rapid Relief.[J]. Frontiers in Immunology.2021.747032.
[4]. Bangaru S , Lang S , Schotsaert M , et al. A Site of Vulnerability on the Influenza Virus Hemagglutinin Head Domain Trimer Interface[J]. Cell, 2019.
[5]. Kim M , Kim S Y , Lee H W , et al. Inhibition of influenza virus internalization by (-)-epigallocatechin-3-gallate.[J]. Antiviral Research, 2013, 100(2):460-472.
▼ 点击阅读原文也可了解更多~