哮喘是由多种免疫细胞参与的,以气道高反应性为主要病理生理变化的慢性气道炎症,临床症状表现为咳嗽,胸闷,伴有哮鸣音等等。哮喘治疗目前主要是非特异性抗炎药(皮质激素类)和气管扩张药(β2 受体激动剂),在多数病人中有一定治疗效果,但是不同的病人反应不一。过敏性哮喘是有 IgE 介导的Ⅰ型超敏反应,IgE 与靶细胞表面的 IgE Fc 受体结合,发生侨联、移位、变构,效应细胞释放白三烯(LTs)、血小板活化因子(PAF)、前列腺素 D2 等生物学活性物质作用于靶器官、组织,引起局部或者全身病理变化 [1]。
在过去的几十年中,过敏性哮喘在全世界范围广泛流行,不仅是发达国家地区,在发展中国家也有越来越多的人受其困扰,过敏性哮喘已经成为全球性的问题,全球有超过 3 亿的人受到哮喘的困扰这种想象的原因目前还不清楚 [1; 2]。近些年,哮喘发病率一直呈现上升趋势,其发病明显的地域性,发达工业国家比发展中国家发病率明显高很多,提示我们环境与个人卫生水平与过敏性疾病的发生成负相关。1989 年,Strachan 提出「卫生学假说」(Hygiene Hypothesis)(图二 Fig2),他发现在婴儿期和儿童早期从兄弟那里获得性感染之后,可以避免特异性疾病的发生,家庭人口的多少与过敏性鼻炎患病率成负相关,提示新生儿时期,环境中微生物的多少与免疫耐受的形成以及过敏性疾病的发生相关 [1; 3](图 1 Fig1)。现代化的都市生活降低了感染微生物的机会,使得免疫系统受病原体刺激减少,这可能会影响免疫系统的发育。在卫生学假说的基础上,Graham A. W. Rook 教授在 2005 年提出了老朋友假说(Old Friends' mechanism),人类的免疫系统受到环境中各种微生物的驱动而进化,形成免疫耐受,这类微生物包括存在人肠道、皮肤、肺脏等的各种细菌,出生时获得的慢性感染,持续存在人体内的蠕虫,来自于环境中的微生物等。例如蠕虫寄生人体,很难被完全清除,这就需要在宿主形成免疫耐受(图 2,Fig2)。随着工业文明的进程,人类生活在塑料和混凝土构成的环境,这些「老朋友」快速减少,有的甚至被消灭,这种驱动人体免疫系统进化的微生物的缺失会造成机体免疫调节功能缺陷,表现为各种慢性炎症性疾病的出现,例如过敏,肠炎,自身免疫病等 [4; 5]。由此可以想到,寄生虫感染是不是可以减少过敏性疾病的发生,利于过敏性疾病的治疗?
答案是肯定的。
1. 过敏性哮喘发生的免疫学机制
从临床上说,虽然很分类了很多类型的的哮喘,但是在过去的 30 年,最常见的依然是过敏性哮喘。在大部分哮喘病人的肺部,尤其是过敏性哮喘的病人,过敏源特异的 Th2 型细胞。Th2 细胞通过释放 IL-4、IL-5、IL-9、IL-10 和 IL-13 等细胞因子,诱导 Th2 型反应,如支气管黏膜嗜酸性粒细胞的浸润和 IgE 的产生。Th1/Th2 失衡是过敏性哮喘形成和发展的关键机制。也有研究表明 Th17/Treg 失衡与哮喘疾病密切相关 [1; 6](图三,Fig3)。
2. 寄生虫在过敏性哮喘中的作用
传统观点认为,寄生虫的角色是引起宿主过敏反应的过敏原,但很多研究结果显示如蠕虫作为寄生虫的一个大类别,其感染可以抑制包括过敏性哮喘在内的很多过敏性及自身免疫性疾病,寄生虫感染引起的免疫学机制可以调节宿主免疫,可能会控制过敏性疾病的发生和发展(图 3,Fig3)[7]。
2.1 美洲钩虫 Necator americanus
研究显示,钩虫感染可以降低过敏性哮喘的风险 [8]。Navarro S 等进一步检测了钩虫蛋白 anti-inflammatory protein-2 (AIP-2) 对于治疗气道过敏性炎症的作用,在小鼠哮喘模型中,应用 AIP-2 可以减轻哮喘症状,其机制与树突状细胞(DCs)和调节性 T 细胞(Tregs)相关。让人振奋的是,AIP-2 同样可以抑制人 DCs 和 Tregs 的激活,这为临床的应用提供了可能 [9]。
2.2 血吸虫 Schistosoma mansoni
血吸虫感染可以减轻气道炎症反应,这与感染虫期和调节性 T 细胞的产生相关 [10]。血吸虫虫卵抗原可以使得调节性 T 细胞(CD4+CD25+Tregs)的数量和反应性增强,这类 Treg 分泌 IL-10 增加,但是 IL-4 没有显著变化;在小鼠哮喘模型中,血吸虫虫卵抗原可以降低 Th2 型细胞因子的产生,减轻气道炎症 [11]。日本血吸虫相关抗原免疫后能有效调节过敏性哮喘小鼠体内细胞因子的平衡,同时对哮喘小鼠嗜酸性粒细胞在肺组织中的浸润和肺组织炎症都有一定的抑制作用;血吸虫可溶性虫卵抗原(SEA)、可溶性成虫抗原(SWA)和可溶性童虫抗原(SSA)均能降低哮喘小鼠肺泡灌洗液中 Th2 型细胞因子水平,升高 Th1 型细胞因子水平 [12; 13]。Ren J 等报道,从血吸虫虫卵抗原 SjP40 蛋白中鉴定出 T 细胞表位,在小鼠哮喘模型中,应用这类表位肽可以诱导表达 Th1 型细胞因子和抑制 Th2 型细胞因子的产生,具有减轻气道炎症的效果 [14]。
2.3 旋毛虫 Trichinella spiralis
旋毛虫作为一种常见人兽共患的蠕虫,有研究发现,宿主感染旋毛虫之后,过敏性哮喘的症状得到一定程度缓解。在卵清蛋白(OVA)诱导的小鼠哮喘模型中,与未感染组相比,旋毛虫感染组的支气管肺泡灌洗液中的巨噬细胞和嗜酸性粒细胞各减少 23% 和 52%,同时调节性细胞因子 IL-10 和 TGF-β升高,这说明,旋毛虫感染宿主之后,在宿主机体中可诱导出免疫抑制效应,从而减轻过敏性及自身免疫性疾病的症状 [15]。Aranzamendi C 等人发现,小鼠哮喘模型中,旋毛虫感染急性期到慢性期的过程,对于气道炎症的抑制能力是逐渐增强的,这可能与调节性 T 细胞的产生相关,过继转移旋毛虫慢性感染期的 CD4+脾淋巴细胞,可一定程度减轻气道炎症 [16]。Kang SA 研究发现,旋毛虫感染可以促进调节性 T 细胞(Tregs)的增殖和功能性激活;与未感染组相比,旋毛虫感染诱导的 Treg 会更加有效的迁移至炎症部位并发挥抑制效应,且过继转移这类 Treg 可以有效预防及治疗过敏性气道炎症疾病 [17]。
2.4 猪鞭虫 Trichuris suis
Ebner F 等研究发现,在小鼠哮喘模型中,应用猪鞭虫分泌抗原(Ts E/S),可以抑制气道高反应性、减少细支气管炎症浸润、降低过敏原特异性 IgE 的产生,这种缓解气道炎症的作用部分原因是 IL-10 的产生,并且在分泌抗原中明确鉴定出三个有效的蛋白分子 [18]。
2.5 多形螺旋线虫 Heligmosomoides polygyrus
早在 2006 年,Kitagaki K 等人就应用多形螺旋线虫在小鼠哮喘模型中进行研究,发现感染组过敏原特异性的嗜酸性粒细胞减少,气道高反应性受到抑制;在体外实验中发现 Th2 反应受到抑制,其机制可能与调节性 T 细胞(CD4+CD25+FoxP3+Treg)的增加和 IL-10 的分泌增多相关 [19]。2012 年,McSorley HJ 等研究发现,OVA 诱导的过敏性哮喘小鼠的模型中,应用多形螺旋线虫排泄分泌抗原 HEA,可以抑制嗜酸性粒细胞聚集、炎症因子的分泌,同时调节性 T 细胞 CD4+ FoxP3+Treg)比例增大以及 IL-5 相关反应被抑制,从而抑制过敏性气道炎症;且该研究对比了热处理后的 HEA 的功能,提示 HEA 中的调节过敏性炎症的分子有热稳定和热不稳定之别 [20]。2015 年 McSorley HJ 也应用 HES 开展了相关研究,在 OVA-Alum 诱导的小鼠哮喘模型中,观察到了相似的炎症抑制效应,且应用缺失鼠模型进行研究,有了不同发现,这种抑制效应的机制不依赖于 MyD88-、TRIF-、调节性 T 细胞、B 细胞,MyD88-、TRIF-、调节性 T 细胞、B 细胞缺失之后,炎症抑制效应依然存在,这表明早期固有免疫细胞参与了这种抑制效应 [21]。
2.6 华支睾吸虫 Clonorchis sinensis
Jeong YI 等用华支睾吸虫总蛋白 Cs-TP 干预 OVA 致敏的过敏性哮喘小鼠,OVA 特异的 IgE 和 Th1/Th2 细胞因子分泌减少,哮喘小鼠的气道炎症和气道高反应性减弱,这可能与 Cs-TP 可以干预气道树突状细胞(DC)对 T 细胞极化功能有关 [22]。
2.7 巴西圆线虫 Nippostrongylus brasiliensis
Wohlleben G 等研究发现,巴西圆线虫可以通过依赖 IL-10 的机制来调控 OVA 致敏的过敏性哮喘,且仅在巴西圆线虫感染后只发生过敏化作用之前这一段时间能起到抑制作用 [23]。
寄生虫感染十分普遍,尤其是在发展中国家,系统性清除的计划在许多地区已经开展或者正在开展。虽然这种清除毫无疑问的解决了一系列的公共卫生问题,但是从「卫生学假说」和「老朋友假说」来看,这种清除也许恰好导致的过敏性疾病的发病率增加。正是因为寄生虫对于过敏性疾病的潜在保护性,深入阐明这种保护性产生的相关机制显得尤为重要。由于寄生虫与宿主之间的相互作用十分复杂,多种因素可以影响其与过敏反应之间的作用,例如异位寄生、器官损伤、副作用不易监控等,不得不承认活虫治疗尚有很多缺陷。但寄生虫虫体蛋白以及分泌蛋白等可以在一定程度避免活虫治疗的缺陷,也许在将来会有寄生虫相关生物制剂用于治疗过敏性疾病。
综上,寄生虫能治哮喘,你相信吗?
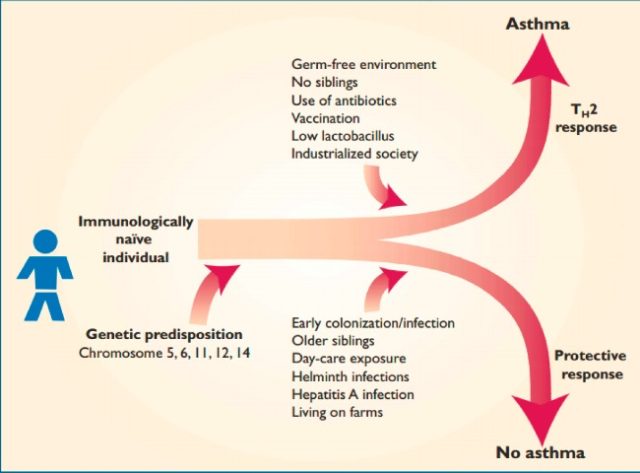
图 1,哮喘是由环境引起的复杂的遗传性状的表达 [1]。
环境因素可以增强 Th2 反应,加快哮喘发病,尤其的在青少年群体;在另一方面,某些环境因素可以增强保护性反应,抑制哮喘发病。
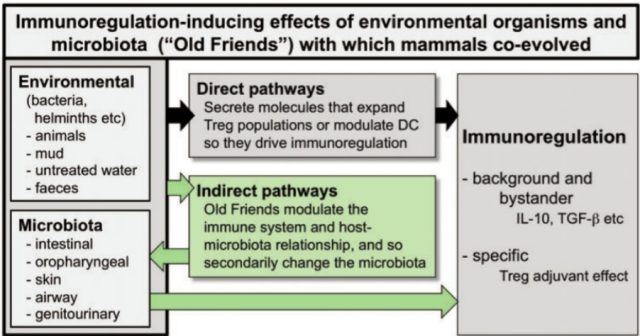
图 2,微生物的免疫调节 [4]。
环境中的微生物,来自于各种微生物群,可以调节免疫系统。其一这类微生物的产物可以直接与免疫系统相互作用;其二微生物对宿主免疫系统的调节同时也将改变宿主与微生物群之间的关系,导致宿主体内微生物群的变化,进一步反过来影响微生物的免疫调节作用。
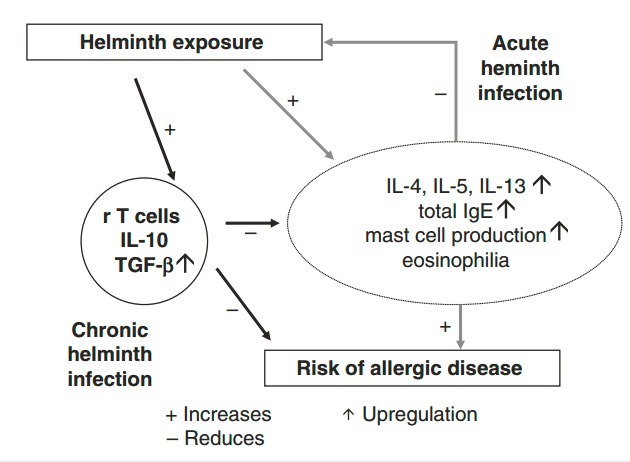
图 3,蠕虫感染和过敏性疾病均能引起强烈的 Th2 型免疫反应 [7]。
IL-4,IL-5,IL-13,总 IgE 以及嗜酸性粒细胞的产生是宿主抗寄生虫反应的部分特点,这既是蠕虫急性感染和过敏性疾病的共同特点。然而,寄生虫感染是倾向于持久的、大部分无症状的。有研究显示,蠕虫通过一种寄生虫特异的免疫调节网络使其可以长期在宿主体内生存,尤其是激活调节性 Treg 和系统性提高 IL-10 分泌水平,同时也可能增加 TGF-β产生。上述机制可能会对过敏性疾病有抑制作用。(r T cells,调节性 T 细胞)
参考文献
[1] Umetsu D T, McIntire J J, Akbari O, Macaubas C, DeKruyff R H. Asthma: an epidemic of dysregulated immunity. Nat Immunol, 2002, 3(8): 715-720.
[2] Loftus P A, Wise S K. Epidemiology and economic burden of asthma. Int Forum Allergy Rhinol, 2015, 5 Suppl 1: S7-S10.
[3] Strachan D P. Hay fever, hygiene, and household size. BMJ, 1989, 299(6710): 1259-1260.
[4] Rook G A, Lowry C A, Raison C L. Microbial 'Old Friends', immunoregulation and stress resilience. Evol Med Public Health, 2013, 2013(1): 46-64.
[5] Rook G A, Brunet L R. Old friends for breakfast. Clin Exp Allergy, 2005, 35(7): 841-842.
[6] Locksley R M. Asthma and allergic inflammation. Cell, 2010, 140(6): 777-783.
[7] Flohr C, Quinnell R J, Britton J. Do helminth parasites protect against atopy and allergic disease? Clin Exp Allergy, 2009, 39(1): 20-32.
[8] Leonardi-Bee J, Pritchard D, Britton J. Asthma and current intestinal parasite infection: systematic review and meta-analysis. Am J Respir Crit Care Med, 2006, 174(5): 514-523.
[9] Navarro S, Pickering D A, Ferreira I B, Jones L, Ryan S, Troy S, Leech A, Hotez P J, Zhan B, Laha T, Prentice R, Sparwasser T, Croese J, Engwerda C R, Upham J W, Julia V, Giacomin P R, Loukas A. Hookworm recombinant protein promotes regulatory T cell responses that suppress experimental asthma. Sci Transl Med, 2016, 8(362): 143r-362r.
[10] Layland L E, Straubinger K, Ritter M, Loffredo-Verde E, Garn H, Sparwasser T, Prazeres D C C. Schistosoma mansoni-mediated suppression of allergic airway inflammation requires patency and Foxp3+ Treg cells. PLoS Negl Trop Dis, 2013, 7(8): e2379.
[11] Yang J, Zhao J, Yang Y, Zhang L, Yang X, Zhu X, Ji M, Sun N, Su C. Schistosoma japonicum egg antigens stimulate CD4 CD25 T cells and modulate airway inflammation in a murine model of asthma. Immunology, 2007, 120(1): 8-18.
[12] 蒋自卫,莫红梅,王磊,程喻力,王淇泓,雷家慧,刘文琪,李雍龙. 日本血吸虫不同阶段抗原免疫抑制过敏性哮喘小鼠气道炎症的实验观察. 中国寄生虫学与寄生虫病杂志,2008,26(6): 428-431, 437.
[13] Cardoso L S, Oliveira S C, Araujo M I. Schistosoma mansoni antigens as modulators of the allergic inflammatory response in asthma. Endocr Metab Immune Disord Drug Targets, 2012, 12(1): 24-32.
[14] Ren J, Hu L, Yang J, Yang L, Gao F, Lu P, Fan M, Zhu Y, Liu J, Chen L, Gupta S, Yang X, Liu P. Novel T-cell epitopes on Schistosoma japonicum SjP40 protein and their preventive effect on allergic asthma in mice. Eur J Immunol, 2016, 46(5): 1203-1213.
[15] Park H K, Cho M K, Choi S H, Kim Y S, Yu H S. Trichinella spiralis: infection reduces airway allergic inflammation in mice. Exp Parasitol, 2011, 127(2): 539-544.
[16] Aranzamendi C, de Bruin A, Kuiper R, Boog C J, van Eden W, Rutten V, Pinelli E. Protection against allergic airway inflammation during the chronic and acute phases of Trichinella spiralis infection. Clin Exp Allergy, 2013, 43(1): 103-115.
[17] Kang S A, Park M K, Cho M K, Park S K, Jang M S, Yang B G, Jang M H, Kim D H, Yu H S. Parasitic nematode-induced CD4+Foxp3+T cells can ameliorate allergic airway inflammation. PLoS Negl Trop Dis, 2014, 8(12): e3410.
[18] Ebner F, Hepworth M R, Rausch S, Janek K, Niewienda A, Kuhl A, Henklein P, Lucius R, Hamelmann E, Hartmann S. Therapeutic potential of larval excretory/secretory proteins of the pig whipworm Trichuris suis in allergic disease. Allergy, 2014, 69(11): 1489-1497.
[19] Kitagaki K, Businga T R, Racila D, Elliott D E, Weinstock J V, Kline J N. Intestinal helminths protect in a murine model of asthma. J Immunol, 2006, 177(3): 1628-1635.
[20] McSorley H J, O'Gorman M T, Blair N, Sutherland T E, Filbey K J, Maizels R M. Suppression of type 2 immunity and allergic airway inflammation by secreted products of the helminth Heligmosomoides polygyrus. Eur J Immunol, 2012, 42(10): 2667-2682.
[21] McSorley H J, Blair N F, Robertson E, Maizels R M. Suppression of OVA-alum induced allergy by Heligmosomoides polygyrus products is MyD88-, TRIF-, regulatory T- and B cell-independent, but is associated with reduced innate lymphoid cell activation. Exp Parasitol, 2015, 158: 8-17.
[22] Jeong Y I, Kim S H, Ju J W, Cho S H, Lee W J, Park J W, Park Y M, Lee S E. Clonorchis sinensis-derived total protein attenuates airway inflammation in murine asthma model by inducing regulatory T cells and modulating dendritic cell functions. Biochem Biophys Res Commun, 2011, 407(4): 793-800.
[23] Marsland B J, Camberis M, Le Gros G. Secretory products from infective forms of Nippostrongylus brasiliensis induce a rapid allergic airway inflammatory response. Immunol Cell Biol, 2005, 83(1): 40-47.
王子霞/文 首都医科大学病原生物学博士